
 键数目比为_______________。
键数目比为_______________。 键数目比为1:1。
键数目比为1:1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
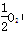 (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1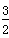 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:As>Cl>P | B.热稳定性:HCl>AsH3>HBr |
| C.还原性:As3->S2->Cl- | D.酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
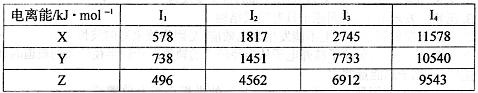
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X原子的电子层数比Y原子的电子层数多 |
| B.X的氢化物的沸点比Y的氢化物的沸点低 |
| C.X的气态氢化物比Y的气态氢化物稳定 |
| D.Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com