
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。

试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式:__________,EF段生成含氧元素离子的名称是_______________。
(2)合金中,铝的质量为_________g,铁的质量为_____________g 。
(3)C的值为______________mL。
(4)硝酸溶液的物质的量浓度为____________mol·L-1。
【答案】 NH4++OH-=NH3H2O 偏铝酸根或四羟基合铝酸根 0.216 1.344 7 1.48
【解析】本题主要考查硝酸的性质。
(1)反应过程中DE段沉淀的物质的量不变,反应的离子方程式:NH4++OH-=NH3H2O,EF段氢氧化铝转化为偏铝酸钠或四羟基合铝酸钠,生成含氧元素离子的名称是偏铝酸根或四羟基合铝酸根。
(2)溶解氢氧化铝消耗2mL氢氧化钠溶液,对应地氢氧化铝的物质的量为4 mol L -1 ×2mL=0.008mol,所以合金中,铝的质量为0.008mol×27g/mol=0.216g,反应NH4++OH-=NH3H2O消耗3mL氢氧化钠溶液,NH4+的物质的量为4 mol L -1 ×3mL=0.012mol,NH4+为还原产物,Fe3+、Al3+为氧化产物,根据电子守恒可得8n(NH4+)=3n(Al3+)+3n(Fe3+),n(Fe3+)=0.24mol,所以铁的质量为0.024mol×56g/mol=1.344g。
(3)E点溶液为硝酸钠溶液,此时硝酸钠的物质的量为4 mol L -1 ×34mL=0.136mol,在C对应的溶液中含有硝酸钠、硝酸铁、硝酸铝、硝酸铵,硝酸根的物质的量为n(NH4+)+3n(Al3+)+3n(Fe3+)+4mol/LC=0.136mol,C=7。
(4)E点溶液中硝酸钠的物质的量为0.136mol,NH3H2O的物质的量为0.012mol,所以硝酸的物质的量为0.136mol+0.012mol=0.148mol,硝酸溶液的物质的量浓度为0.148mol/100mL=1.48mol·L-1。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】用括号中的试剂除去各组物质中的杂质,可选试剂不正确的是
A. 乙醇中的水(新制CaO)
B. 乙烷中乙烯(溴水)
C. 苯中的甲苯(溴水)
D. 乙酸乙酯中的乙酸(饱和Na2CO3溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用右图所示装置制取氨气。请回答下列问题:

(1)实验室制备氨气的化学方程式是____________________________________________________。
(2)请指出装置中的两处错误
①____________________________;②____________________________。
(3)检验试管中收集满氨气的方法是___________________________________________________。
(4)用下列装置吸收多余的氨气,最合理的是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶溶液只含Cl﹣、CO32﹣、SO42﹣、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
①原溶液 ![]() 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,回答下列问题:
(1)试分析原溶液中一定含有的离子是 , 一定不含有的离子是 , 可能含有的离子是 .
(2)有的同学认为实验③可以省略,你认为是否正确 (填“是”或“否”) , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成配平:
Fe2++ ClO-+ = Fe(OH)3↓+ C1-+
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组对某硫酸亚铁晶体(FeSO4xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4xH2O中的x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL0.1mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是
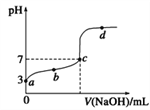
A. a点表示溶液中c(CH3COO-)约为10-3 mol/L
B. b点表示的溶液中c(CH3COO-)< c(Na+)
C. c点表示CH3COOH和NaOH恰好反应完全
D. b、d点表示的溶液中 的值不相等
的值不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
CO(g)+H2(g),当增加反应物物质的量时,则平衡向正反应方向移动;
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率升高;
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体总物质的量增大的方向移动;
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
A. ①④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com