
【题目】时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含![]() 浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
①在中性溶液中,用溴将试样中![]() 氧化成
氧化成![]() ,将过量的溴除去
,将过量的溴除去
②再加入过量的碘化钾,在酸性条件下,使![]() 完全转化成
完全转化成![]()
③将②中生成的碘完全萃取后,用肼将其还原成![]() ,方程式为
,方程式为![]()
④将生成的![]() 萃取到水层后用
萃取到水层后用![]() 法处理
法处理
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化
⑥将⑤反应后的溶液以淀粉作指示剂,用![]() 标准溶液滴定,方程式为:
标准溶液滴定,方程式为:![]()
经过上述放大后,则溶液中![]() 浓度放大为原溶液中
浓度放大为原溶液中![]() 浓度的(设放大前后溶液体积相等)
浓度的(设放大前后溶液体积相等)
A.2倍B.4倍C.6倍D.36倍
【答案】D
【解析】
①第一步反应的离子方程式为I-+3Br2+3H2O=6Br-+IO3-+6H+,由方程式可知1个I-生成1个IO3-,I原子个数没有变化;
②第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,由方程式可知1个IO3-生成3个I2,与①相比I原子个数放大了6倍;
③第三步反应的离子方程式为N2H4+2I2=4I-+N2↑+4H+,由方程式可知1个I2生成2个I-,与②相比I原子个数没有变化;
④第四步反应的离子方程式为I-+3Br2+3H2O=6Br-+IO3-+6H+,由方程式可知1个I-生成1个IO3-,与③相比I原子个数没有变化;
⑤第五步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,由方程式可知1个IO3-生成3个I2,与④相比I原子个数放大了6倍;
⑥第六步反应的离子方程式为2S2O32-+I2=S4O62-+2I-,由方程式可知1个I2生成2个I-,与⑤相比I原子个数没有变化;
则⑥与①相比,I原子个数放大了6×6=36倍,即I-浓度放大了36倍,故选D。


科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属。工业上常用硫酸酸解钛铁矿(主要成分为FeTiO3,还含有部分Fe2O3)的方法制取金红石(TiO2),再还原TiO2制取金属钛。工业制取TiO2的工艺流程图如下:

回答下列问题:
(1)钛酸亚铁(FeTiO3)中Ti的化合价为________________________。
(2)钛液1中钛以TiO2+的形式存在,则FeTiO3与硫酸反应的离子方程式为________。
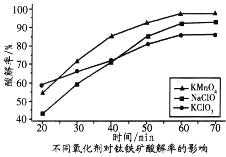
(3)为提高钛铁矿的酸解率,可添加适量氧化剂,依据右图判断,添加的最佳氧化剂为_____________(填化学式)。
(4)钛液1中加入的A物质是____________,流程中的操作a是____________。
(5)制取金红石过程中,需要测定TiO2+的含量。取100mL钛液1,加铝粉,使其发生反应3TiO2++Al+6H+=3Ti3++Al3++3H2O,反应消耗铝1.35g,则钛液1中TiO2+的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用如图所示装置制取氯气,下列说法不正确的是
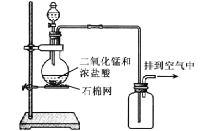
A.为了防止氯气污染空气,必须进行尾气处理
B.该装置图中存在两处明显错误
C.该实验装置中收集氯气的方法不正确
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以检验是否有氯气逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,下列判断正确的是
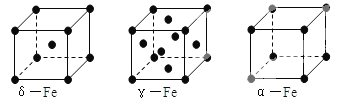
A. δ、γ、α铁晶体中存在金属阳离子和阴离子
B. γ—铁晶体晶胞中所含有的铁原子数为14
C. δ、α两种晶胞中铁原子的配位数之比为4∶3
D. 若α-Fe晶胞边长为a cm,γ-Fe晶胞边长为b cm,则两种晶体的密度比为b3∶a3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.在pH=7的溶液中:Fe3+、K+、Cl-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.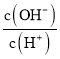 =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.水电离产生的c(OH-)=10-12 mol/L的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是
A. 实验室用装置A制取并收集二氧化硫
实验室用装置A制取并收集二氧化硫
B.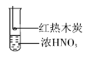 装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
C.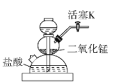 装置C可用于二氧化锰与浓盐酸反应制备氯气
装置C可用于二氧化锰与浓盐酸反应制备氯气
D.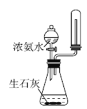 实验室用装置D制取少量氨气
实验室用装置D制取少量氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. “可燃冰”是将水变为油的新型燃料,具有热值高、无污染等优点
B. 淀粉、纤维素和油脂都是天然高分子化合物
C. N2(g)+3H2(g)![]() 2NH3(g)采用高温、高压的条件有利于提高氨的产量
2NH3(g)采用高温、高压的条件有利于提高氨的产量
D. 催化剂能够加快化学反应速率是由于其参与了化学反应并改变了反应的路径,使反应所需的活化能降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛用途。
(1)化学氧化法生产高铁酸钾(K2FeO4)是用固体Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸钾和KNO2等产物。此反应中氧化剂与还原剂的物质的量之比为_____________。
(2)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图所示:

①反应Ⅰ的化学方程式为_________________________________________________。
②反应Ⅱ的离子方程式为_________________________________________________。
③加入饱和KOH溶液的目的是_________________________________________________。
④高铁酸钾是一种理想的水处理剂,其处理水的原理为____________________________。
⑤实验室配制Fe(NO3)3溶液,为防止出现浑浊,一般是将Fe(NO3)3固体溶于稀HNO3后再加水稀释。已知25 ℃时,Ksp[Fe(OH)3]=4×10-38,此温度下在实验室中配制100 mL 5 mol·L-1 Fe(NO3)3溶液,则至少需要________mL、4 mol·L-1 HNO3。

(3)高铁酸钠(Na2FeO4)制备可采用三室膜电解技术,装置如图所示,阳极的电极反应式为________。电解后,阴极室得到的A溶液中溶质的主要成分为________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com