
【题目】钛被称为继铁、铝之后的第三金属。工业上常用硫酸酸解钛铁矿(主要成分为FeTiO3,还含有部分Fe2O3)的方法制取金红石(TiO2),再还原TiO2制取金属钛。工业制取TiO2的工艺流程图如下:

回答下列问题:
(1)钛酸亚铁(FeTiO3)中Ti的化合价为________________________。
(2)钛液1中钛以TiO2+的形式存在,则FeTiO3与硫酸反应的离子方程式为________。
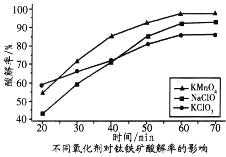
(3)为提高钛铁矿的酸解率,可添加适量氧化剂,依据右图判断,添加的最佳氧化剂为_____________(填化学式)。
(4)钛液1中加入的A物质是____________,流程中的操作a是____________。
(5)制取金红石过程中,需要测定TiO2+的含量。取100mL钛液1,加铝粉,使其发生反应3TiO2++Al+6H+=3Ti3++Al3++3H2O,反应消耗铝1.35g,则钛液1中TiO2+的物质的量浓度为________。
【答案】+4价 FeTiO3+4H+=TiO2++Fe2++2H2O KMnO4 铁粉或铁 洗涤、干燥 1.5mol/L
【解析】
本题主要考查制备实验方案的设计。
钛铁矿和硫酸混合,钛铁矿和硫酸反应的产物之一是TiOSO4,钛铁矿中含有Fe2O3,故反应后的钛液1中含有Fe3+,故需向钛液1中加入铁屑,发生反应2Fe3++Fe=3Fe2+,反应后溶液中溶质为TiOSO4和FeSO4,再将溶液冷却结晶、过滤得到绿矾和钛液2,钛液2中含有TiOSO4,先将钛液2中加入沸水,TiO2+水解生成H2TiO3,然后过滤回收硫酸,同时将固体干燥得到H2TiO3,再经过煅烧得到TiO2,据此分析解答。
(1)钛酸亚铁(FeTiO3)中Fe为+2价,O为-2价,根据化合物中各元素化合价代数和为0可知,Ti为+4价;
(2)由上述分析可知,FeTiO3与硫酸反应的离子方程式为:FeTiO3+4H+=TiO2++Fe2++2H2O;
(3)由图分析可知,最佳氧化剂为KMnO4;
(4)钛液1中含有Fe3+,故需向钛液1中加入铁屑,将Fe3+还原;操作a的目的是得到较纯的H2TiO3固体,故操作a是洗涤、干燥;
(5)由3TiO2++Al+6H+=3Ti3++Al3++3H2O可知,每消耗1molAl的同时,会消耗3molTiO2+,100mL钛液1消耗0.05molAl,即100mL钛液1中含有0.15molTiO2+,故钛液1中TiO2+的物质的量浓度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】写出下列反应的化学反应方程式(注明反应条件)并指出反应类型
(1)乙烯在一定条件下与水反应 ___________________________________,__________
(2)苯与浓硝酸反应______________________________________________,__________
(3)乙酸与丙醇反应______________________________________________,__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性.Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 浓HNO3加热 | 有红棕色气体 | HNO3有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
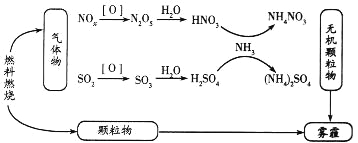
回答下列问题:
(1)NH3的电子式为____________,NH4NO3中含有的化学键是________________:
(2)下列关于雾霾的叙述错误的是________(填序号)
A.雾霾中含有硝酸铵和硫酸铵 B.NH3是形成无机颗粒物的催化剂
C.雾霾的形成与过度施用氮肥有关 D.雾霾的形成过程涉及氧化还原反应
(3)预防含硫化合物雾霾生成的方法之一是将氨气和二氧化硫通入水中,再充入O2充分反应生成一种正盐,该反应的化学方程式为________________________。预防含氮化合物雾霾生成的方法之一是用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸,电解后该溶液的pH_______(填“变大”“变小”或“不变”)。
(4)在有氧条件下,催化剂能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380℃时,NOx的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是__________________________。在无氧条件下,反应器中NH3能将NO2还原为N2,当生成1mol N2时转移电子________mol(可用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
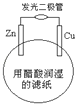
A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件已略去)。下列推断错误的是
![]()
A. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
B. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
C. 若D是一种强碱,则A.B.C均可与X反应生成D
D. 若D是一种强酸,则A 既可是单质也可是化合物,且D 可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
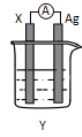
(1)电极X的上发生的电极反应为______反应(氧化或还原);电解质溶液Y是________;
(2)银电极为电池的_____极,发生的电极反应式为_______;
(3)外电路中的电子__________(填“流出”或“流向”)Ag电极。
(4)当有1.6 g铜溶解时,银棒增重______ g。
(5)现有如下两个反应:(A))NaOH+HCl=NaCl+H2O (B)2FeCl3+Fe=3FeCl2
①根据两反应本质,分别判断能否用于设计原电池,如果不能,说明其原因_______________。
②如果可以,写出正极反应式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com