
【题目】乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成份。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展的重要标志)
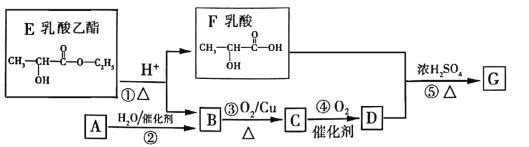
(1)A分子的空间构型是_______。
(2)D的化学式是_______________,F中含氧官能团的名称是______________。
(3)②的化学方程式是___________,⑤的反应类型是_________
(4)1mol乳酸与足量NaOH反应,消耗NaOH__________mol。
(5)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%。下列转化符号绿色化学要求的是__________(填序号)。
a.乙醇制取乙醛 b.甲烷制备CH3Cl c.2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
【答案】平面长方形 C2H4O2 羟基、羧基 CH2 =CH2 +H2O ![]() CH 3CH2OH 酯化反应(取代反应) 1 c
CH 3CH2OH 酯化反应(取代反应) 1 c
【解析】
烃A是衡量一个国家石油化工发展的重要标志,则A为CH2=CH2;A与H2O发生加成反应生成B的结构简式为CH3CH2OH,催化氧化生成C的结构简式为CH3CHO,再催化氧化生成D的结构简式为CH3COOH;乳酸乙酯在酸性条件下水解生成乳酸和乙醇,乳酸与CH3COOH在浓硫酸、加热条件下发生酯化反应生成G的结构简式为![]() 。
。
(1)A为CH2=CH2,分子的空间构型是平面长方形。答案为:平面长方形;
(2)D为CH3COOH,化学式是C2H4O2,F为![]() ,含氧官能团的名称是羟基、羧基。答案为:C2H4O2;羟基、羧基;
,含氧官能团的名称是羟基、羧基。答案为:C2H4O2;羟基、羧基;
(3) 反应②为CH2=CH2与H2O加成生成CH3CH2OH,化学方程式是CH2=CH2 +H2O ![]() CH 3CH2OH,反应⑤是乳酸与CH3COOH在浓硫酸、加热条件下反应生成
CH 3CH2OH,反应⑤是乳酸与CH3COOH在浓硫酸、加热条件下反应生成![]() 和H2O,反应类型是酯化反应(取代反应)。答案为:CH2=CH2 +H2O
和H2O,反应类型是酯化反应(取代反应)。答案为:CH2=CH2 +H2O ![]() CH 3CH2OH;酯化反应(取代反应);
CH 3CH2OH;酯化反应(取代反应);
(4)乳酸的结构简式为![]() ,只有-COOH能与NaOH发生反应,所以1mol乳酸与足量NaOH反应,消耗NaOH 1 mol。答案为:1;
,只有-COOH能与NaOH发生反应,所以1mol乳酸与足量NaOH反应,消耗NaOH 1 mol。答案为:1;
(5) a.乙醇制取乙醛,发生反应为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,a不合题意;
2CH3CHO+2H2O,a不合题意;
b.甲烷制备CH3Cl,发生反应为CH4+Cl2![]() CH3Cl+HCl,b不合题意;
CH3Cl+HCl,b不合题意;
c.2CH3CHO+O2![]() 2CH3COOH,只生成一种产物,c符合题意;
2CH3COOH,只生成一种产物,c符合题意;
故选c。答案为:c。


科目:高中化学 来源: 题型:
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
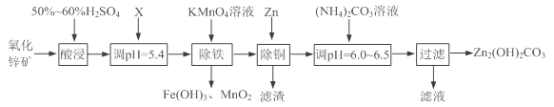
(1)“酸浸”时保持H2SO4过量的目的是___________。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:___________。
②流程中调节pH=5.4所加试剂X为____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中滤渣的成分为___________(写化学式);“滤液”可以用作化肥,该滤液的主要成分为___________(填化学式)。
(4)检验Zn2(OH)2CO3是否洗涤干净的方法是___________。
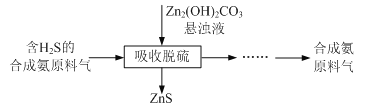
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:
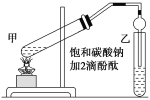
(1)连接好装置后,在加入试剂之前需要做的操作是________________________
(2)在甲试管(如图)中加入2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液,加入上述试剂的顺序为_____________________________________________
(3)甲试管中需加入少量__________以防止暴沸
(4)浓硫酸在反应中的作用是_______________________
(5)甲试管中反应的化学方程式___________________________________________
(6)乙中导管没有深入到液面下,原因是_____________________
(7)上述实验中饱和碳酸钠溶液的作用是:______(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(8)欲将乙试管中的物质分离开得到乙酸乙酯,采取的实验方法是_______;分离时,乙酸乙酯应该从仪器的________(填“下口放出” 或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
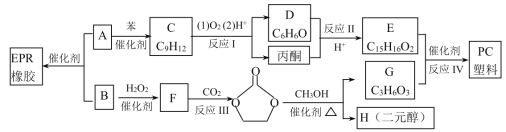
【题目】合成EPR橡胶(![]() )广泛应用于防水材料、电线电缆护套、耐热胶管等;PC塑料(
)广泛应用于防水材料、电线电缆护套、耐热胶管等;PC塑料(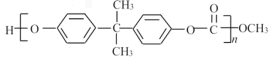 )透光性良好,可制作挡风玻璃以及眼镜等。它们的合成路线如下:
)透光性良好,可制作挡风玻璃以及眼镜等。它们的合成路线如下:
已知:①![]()
②(CH3)2C=CHCH3+H2O2![]()
![]() +H2O
+H2O
③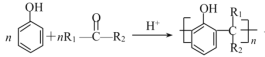 +nH2O
+nH2O
(1)A的名称为________,反应Ⅲ的反应类型为___________,H的结构简式为___________。
(2)在工业生产过程中,反应Ⅰ除了能得到高纯度的苯酚和丙酮之外,还能回收副产物![]() 和______________。
和______________。
(3)反应Ⅱ发生时,条件控制不当有可能生成高分子化合物,其结构简式可能是________。
(4)反应Ⅳ的化学方程式为_____________________________。
(5)有机物E满足下列条件的同分异构体有__________种。
①含2个苯环和2个羟基,且2个羟基不能连在同一个碳上
②与FeCl3溶液不能显紫色
③核磁共振氢谱显示有5组峰,峰面积比为1:2:2:2:1
(6)已知: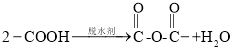 。以邻二甲苯和苯酚为原料合成酚酞(
。以邻二甲苯和苯酚为原料合成酚酞(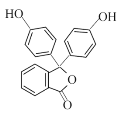 ),无机试剂任选,写出合成路线________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
),无机试剂任选,写出合成路线________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g) + O2(g)![]() TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
Ⅱ.2C(s) + O2(g) ![]() 2CO(g) ΔH =-220.9 kJ/mol
2CO(g) ΔH =-220.9 kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g)![]() TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
(2)toC时,向10L恒容密闭容器中充入1mol TiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
① 反应4min末的平均速率v(Cl2)=_____,该温度下K =____(用分数表示),O2的平衡转化率=_______.
② 下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是________
A.缩小容器的体积 B.加入催化剂 C.分离出部分TiO2
D.增加O2的浓度 E.减低温度 F.以上方法均不可以
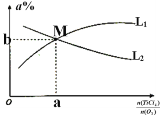
③toC时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图所示:能表示O2的平衡转化率的曲线为_________ (填“L1”或“L2”)M点的坐标为______________(用整数或分数表示)
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c(NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.升高温度能提高活化分子的比例,从而加快反应速率
B.胶体和溶液的本质区别是有无丁达尔效应
C.将![]() 饱和溶液滴入
饱和溶液滴入![]() 溶液中,可获得
溶液中,可获得![]() 胶体
胶体
D.![]() 与
与![]() 都属于酸性氧化物,都能与水反应生成相应的酸
都属于酸性氧化物,都能与水反应生成相应的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A的蒸汽对氢气的相对密度是15,且能发生银镜反应,F的分子式为C3H6O2。有关物质的转化关系如下:
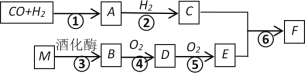
请回答:
(1)B中含有的官能团名称是__________,反应⑥的反应类型为__________。
(2)写出A发生银镜反应的化学方程式__________。
(3)写出反应④的化学方程式__________。
(4)写出有机物F与NaOH溶液反应的化学方程式__________。
(5)下列说法正确的是__________。
A 有机物D的水溶液常用于标本的防腐
B 有机物B、C、E都能与金属钠发生反应
C 有机物F中混有E,可用饱和碳酸钠溶液进行分离
D 有机物M为高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com