
【题目】TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g) + O2(g)![]() TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
Ⅱ.2C(s) + O2(g) ![]() 2CO(g) ΔH =-220.9 kJ/mol
2CO(g) ΔH =-220.9 kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g)![]() TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
(2)toC时,向10L恒容密闭容器中充入1mol TiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
① 反应4min末的平均速率v(Cl2)=_____,该温度下K =____(用分数表示),O2的平衡转化率=_______.
② 下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是________
A.缩小容器的体积 B.加入催化剂 C.分离出部分TiO2
D.增加O2的浓度 E.减低温度 F.以上方法均不可以
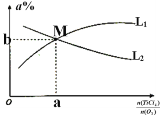
③toC时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图所示:能表示O2的平衡转化率的曲线为_________ (填“L1”或“L2”)M点的坐标为______________(用整数或分数表示)
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c(NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
【答案】+45.5kJ/mol 0.01 mol/(Lmin) ![]() 10% F L1 (1,
10% F L1 (1,![]() ) > 1.25×103
) > 1.25×103
【解析】
(1)已知Ⅰ.TiCl4(g)+O2(g)TiO2(s)+2Cl2(g)△H=-175.4kJ/mol
Ⅱ.2C(s)+O2(g)2CO(g)△H=-220.9kJ/mol
根据盖斯定律Ⅰ-Ⅱ得TiCl4(g)+2CO(g)TiO2(s)+2C(s)+2Cl2(g)△H=(-175.4+220.9)kJ/mol=+45.5kJ/mol;
(2)初始投料为1molTiCl4和2mol O2,容器体积为10L,列三段式有:
 ;
;
①反应0~4min末的平均速率v(Cl2)=![]() =0.01 mol/(Lmin);根据平衡常数的定义可知K=
=0.01 mol/(Lmin);根据平衡常数的定义可知K=![]() ;O2的平衡转化率=
;O2的平衡转化率=![]() =10%;
=10%;
②A.缩小容器的体积,相当于增大压强,该反应是气体体积不变的反应,平衡不移动,不能增大氧气的转化率,故A错误;
B.加入催化剂,只改变反应速率,不改变平衡状态,不能增大氧气的转化率,故B错误;
C.分离出部分TiO2,使平衡正向移动,但不能加快正反应速率,故C错误;
D.增大氧气浓度,反应速率加快,平衡正向移动,但起始物质的量增大,转化率减小,故D错误;
E.温度降低,反应速率减慢,故E错误;
F.由上述分析可知,方法均不合理,故F正确,所以答案为F;
③TiCl4的量为定值,则随着氧气的物质的量的增加,平衡逐渐正向移动,TiCl4的转化率逐渐增大,即![]() 越小TiCl4的转化率越大,同理可知
越小TiCl4的转化率越大,同理可知![]() 越大,氧气的转化率越大,所以L1代表O2的平衡转化率曲线;
越大,氧气的转化率越大,所以L1代表O2的平衡转化率曲线;
M点二者的转化率相同,则这两物质的起始物质的量相等,列三段式有:
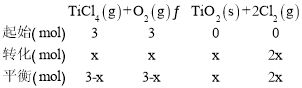
根据第(2)小题可知该温度下平衡常数为![]() ,该反应前后气体的计量数之和相等,所以可以用物质的量来代替浓度计算平衡常数,所以有
,该反应前后气体的计量数之和相等,所以可以用物质的量来代替浓度计算平衡常数,所以有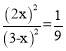 ,解得x=
,解得x=![]() ,转化率为
,转化率为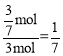 ,所以坐标为(1,
,所以坐标为(1,![]() );
);
(3)已知常温下NH3H2O的电离平衡常数Kb=2×10-5molL-1,H2CO3的电离平衡常数Ka1=4×10-7moL-1,Ka2=4×10-11molL-1,NH3H2O的电离程度大于H2CO3的一级电离程度,则HCO3-的水解程度大于NH4+的水解程度,故在NH4HCO3溶液中,c(NH4+)>c(HCO3-);
对于反应NH4++HCO3-+H2ONH3H2O+H2CO3的平衡常数K=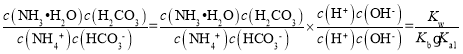 =1.25×10-3。
=1.25×10-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:

已知:i.RCH2Br![]()
![]()
ii.![]()
![]()
iii.![]()
 (以上R,
(以上R,![]() ,
,![]() 代表氢,烷基或芳基等)
代表氢,烷基或芳基等)
(1)A属于芳香烃,其名称是___________。
(2)B的结构简式是___________。
(3)C生成D的化学方程式是___________
(4)由G生成H的反应类型是___________,试剂b是___________。
(5)下列说法正确的是______(选填字母序号)。
a.G存在顺反异构体
b.由G生成H的反应是加成反应
c.1molG最多可以与1molH2发生加成反应
d.1molF或1molH与足量NaOH溶液反应,均消耗2 mol NaOH
(6)E有多种同分异构体,其中属于芳香族化合物,并既能发生加聚反应又能发生水解反应的有_____种(不考虑立体异构)。
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
,写出合成路(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159g/cm3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280mL/mL水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制取一氯甲烷:
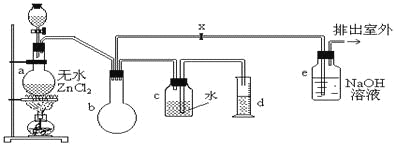
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式_____,其反应类型属于___反应;
(2)装置b的作用是____;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为____;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是____;
(5)实验中实际按甲醇和浓盐酸1︰2(物质的量之比)进行反应的理由是_____;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是______;
(7)实验结束后,d中收集到的液体中含有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:则下列说法正确的是
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH =-41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g) +1/2O2(g)=H2O(l):ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成份。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展的重要标志)
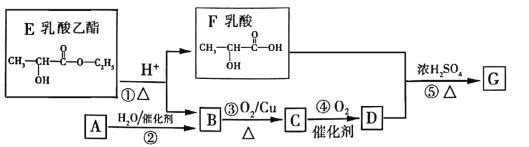
(1)A分子的空间构型是_______。
(2)D的化学式是_______________,F中含氧官能团的名称是______________。
(3)②的化学方程式是___________,⑤的反应类型是_________
(4)1mol乳酸与足量NaOH反应,消耗NaOH__________mol。
(5)绿色化学的核心内容之一是“原子经济性”,即原子的理论利用率为100%。下列转化符号绿色化学要求的是__________(填序号)。
a.乙醇制取乙醛 b.甲烷制备CH3Cl c.2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列叙述中正确的是( )
A.石英是制造光导纤维的原料,也是常用的半导体材料
B.刚玉![]() 硬度仅次于金刚石,可做机械轴承,属于无机非金属材料
硬度仅次于金刚石,可做机械轴承,属于无机非金属材料
C.泰国银饰和土耳其彩瓷,其主要成分均为金属材料
D.手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
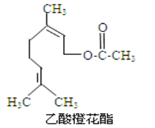
①分子式为C12H20O2 ②能使酸性KMnO4溶液褪色
③可发生取代、加成、消去、但不能发生加聚反应
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物与溴水发生反应最多消耗3molBr2
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为2mol
A. ①②③B. ①②⑥C. ①②⑤⑥D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是
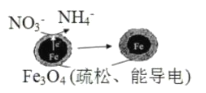
A.能量转化形式主要为化学能转化为电能
B.该原理的总反应可表示为NO3-+3Fe+2H++H2O=NH4++Fe3O4
C.电极材料分别为Fe和Fe3O4
D.负极反应为NO3-+8e-+10H+=NH4++3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com