
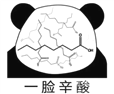
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
A. 7种 B. 11种 C. 14种 D. 17种
【答案】D
【解析】辛酸含有一个“—COOH”和三个“—CH3”的主链最多有6个碳原子。
(1)若主链有6个碳原子,余下2个碳原子为2个—CH3,先固定一个—CH3,移动第二个—CH3,碳干骨架可表示为: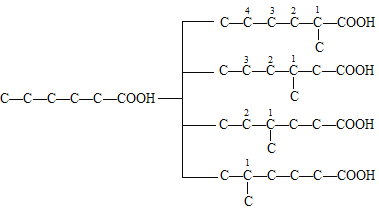 (数字代表第二个—CH3的位置),共4+3+2+1=10种。
(数字代表第二个—CH3的位置),共4+3+2+1=10种。
(2)若主链有5个碳原子,余下3个碳原子为可能为:①一个—CH3和一个—CH2CH3或②一个—CH(CH3)2。①若为一个—CH3和一个—CH2CH3,先固定—CH2CH3,再移动—CH3,碳干骨架可表示为: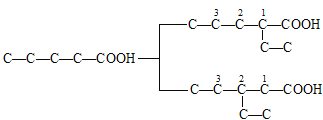 ;②若为一个—CH(CH3)2,符合题意的结构简式为
;②若为一个—CH(CH3)2,符合题意的结构简式为![]() (题给物质);共3+3+1=7种。
(题给物质);共3+3+1=7种。
(3)若主链有4个碳原子,符合题意的同分异构体的结构简式为(CH3CH2)3CCOOH。
辛酸含有一个“—COOH”和三个“—CH3”的同分异构体有10+7+1=18种,除去题给物质,还有17种,答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知某离子晶体晶胞如图所示,其摩尔质量为M,阿伏加德罗常数为NA,晶体的密度为d g/cm3。下列说法中正确的是( )

A. 晶体晶胞中阴、阳离子的个数都为1
B. 其中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为![]() cm
cm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________。
(2)上述反应中氧化剂是______(填化学式),被氧化的元素是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运动员无论是在比赛或者是训练时都是需要大量的体力消耗,需比较快地补充能量,可以饮用葡萄糖水。则葡萄糖在人体内发生的主要反应是( )
A.酯化反应B.氧化反应C.还原反应D.水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解
④ 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 mL ,量取浓硫酸所用的量筒的规格是 。
(从下列中选用 A. 10mL B. 25mL C. 50mL D. 100ml)
(2)第③步实验的操作是
。
(3)第⑤步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的液凹面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性。下列叙述中不正确的是:
A. 红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟
B. 钠在氯气中燃烧,生成白色的烟
C. 纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾
D. 氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
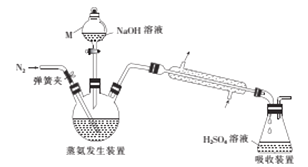
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com