
����Ŀ��ijdz��ɫ����X[x(NH4)2SO4��yFeSO4��zH2O]�ڷ�����ѧ�г�������ԭ��. Ϊȷ������ɣ�ijС��ͬѧ��������ʵ�飮
I��NH4+�IJⶨ
������������װ����ͼ��ʾ��
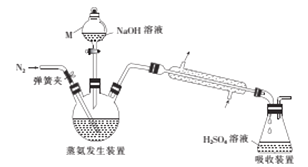
��ص�ʵ�鲽�����£�
��ȷ��ȡ58.80g����X����ˮ�ܽ����Һע��������ƿ�У�
��ȷ��ȡ50.00mL3.0300molL-1H2SO4��Һ����ƿ�У�
����������ƿ�м�������NaOH��Һ��ͨ�뵪��������������������ȡ����ƿ��
����0.120molL-1NaOH����Һ�ζ���ƿ�й��������ᣬ�ζ��յ�ʱ����25.00mL NaOH����Һ��
��1������M������Ϊ__________��
��2��������У�������������ԭ��Ӧ�Ļ�ѧ����ʽΪ____________������������Ϊ�˼���ʵ�����,����Ҫ��ֱ�������ܽ����������������������IJ���������_____________��
��3��������У�����ʱ��ƿ����Һ�彦����������õ�n(NH4+)��ֵ��______(����ƫ������ƫС������������)��
II.SO42-�����IJⶨ
����������������ʵ�鲽������:
����ȷ��ȡ58.80g����X ���ձ��У���ˮ�ܽ⣬�߽�����������BaCl2��Һ��
�ڽ��õ�����Һ������ֽ(�ҷ�������С,�ɺ���)���ˣ�ϴ�ӳ���3~4�Σ�
������ֽ�����ó���ȡ����������ֽ������ֽ��ȫ�һ���
�ܼ������ճ��������ء��������ó�������Ϊ69.90g��
��4���������,�ж�BeCl ��Һ�ѹ�����ʵ�������������___________��
��5���������,������ˮϴ����,����ҪĿ����___________��
��6�����ʵ����ͨ������ó�����X�Ļ�ѧʽΪ__________��ʵ��I �IJ������,��Һ�������ܶ��ɴ�С��˳��Ϊ___________��
���𰸡� ��Һ©�� 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ������ˮ��ϴ��������ͨ��2~3 ������ϴ��Һע����ƿ�� ƫ�� ����Һ�ֲ��,ȡ���ϲ���Һ�������Թ��������Թ��м���1~2��BaCl2��Һ,���ް�ɫ���dz��֣���˵��BaCl2��Һ�ѹ���(��μ�Na2SO4��Һ�����ְ�ɫ��������Ҳ����) �����ܼ��ٳ������ܽ���ʧ����Сʵ����� (NH4)2SO4FeSO46H2O c(SO42-)>c(NH4+)>c(Fe2+ )>c(H+)>c(OH-)
��������I����1������M������Ϊ��Һ©������ȷ�𰸣���Һ©����
(2)�������������������ӷ�Ӧ��������������������ͨ������������Ϊ������������ѧ����ʽΪ4Fe(OH)2+O2+2H2O=4Fe(OH)3������������ֱ���������л����һЩҺ������Բⶨ�������Ӱ�죻���Ϊ�˼���ʵ�����,����Ҫ��ֱ�������ܽ��С������������������IJ���������������ˮ��ϴ��������ͨ��2~3�Σ���ϴ��Һע����ƿ�У���ȷ�𰸣�������ˮ��ϴ��������ͨ��2~3�Σ���ϴ��Һע����ƿ�С�
(3)������У�����ʱ��ƿ����Һ�彦���������������Ƶ�����С����ⶨ��ƿ����Һ��ʣ������������С���백����Ӧ������������࣬�������n(NH4+)����ƫ����ȷ�𰸣�ƫ��
II. ��4���ж��Ȼ����Ƿ�������������ϲ���Һ�м����μ��Ȼ�������û���µij���������˵����Һ��û����������ӣ����Ȼ����Ѿ���������ȷ�𰸣�����Һ�ֲ�����ϲ���Һ�м���1��2��BaCl2��Һ���ް�ɫ���dz��֣���BaCl2��Һ�ѹ�����
(5) ����ˮϴ�ӿ��Լ��ٹ�����ܽ⣬������ϴ�ӻ�ʹ�����ϸ�����������ӣ���Һ��Ҳ������������ӣ����Բ�����������Һϴ�ӳ�����Ӧ��ѡ����ˮϴ��������ҪĿ���Ǿ����ܼ��ٳ������ܽ���ʧ����Сʵ������ȷ�𰸣������ܼ��ٳ������ܽ���ʧ����Сʵ����
(6) ��NaOH��Ӧ����������ʵ���Ϊn��H2SO4��=1/2n(NaOH)=1/2��0.04��0.025=0.0005 mol���백����Ӧ����������ʵ���Ϊ��0.05��1.0100��1/2��0.0400��0.02500=0.05mol�����������ʵ���n��NH3��=2n��H2SO4��=0.1mol��19.60g����X���ձ��У���ˮ�ܽ⣬�߽����������� BaCl2��Һ���õ����ᱵ����23.30g����n��SO42-��=23.3/233=0.1 mol��19.6��2x /(132x+152y+18z)=0.1��19.6��(x+y)/(132x+152y+18z)=0.1����x+y=2x����x=y����x=1����19.6��2/(132+152+18 z)=0.1�� ��z=6�� ��x=1��y=1��z=6�����仯ѧʽΪ��NH4��2SO4FeSO46H2O����x=2����19.6��4/(132��2+152��2+18 z)=0.1�� ��z=1.21�������ϣ����Ծ���X�Ļ�ѧʽΪ(NH4)2SO4��FeSO4��6H2O��������(NH4)2SO4��FeSO4��6H2O ��ˮ�ܽ��笠���������������ˮ���������������ˮ��������笠�����Ũ������������c(NH4+)>c(Fe2+)����������������Ӳ�ˮ��������c(SO42-)>c(NH4+)��ʵ��I�IJ������,��Һ�������ܶ��ɴ�С��˳��c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)����ȷ�𰸣�(NH4)2SO4��FeSO4��6H2O��c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
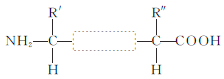
����Ŀ������ȤζͼƬ��һ�����ᡱ�������������ظ�����������ļ���ʽ�ṹ����ͼ�����������ͬ���칹���У� ����һ������COOH������������CH3���Ľṹ�������������칹������![]() �⣬����(����)
�⣬����(����)
A. 7�� B. 11�� C. 14�� D. 17��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������б仯�У���Ҫ������ʵ�����������ʵ�ֵ��ǣ� ��
A.HCl��H2
B.CO2��CO
C.Fe2O3��Fe
D.Br����Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ϸ���ڲ����л�������ĸ���ͼ����ش��������⡣
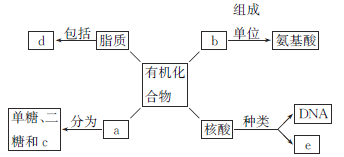
��1��С�������еĴ�������c��________���˺Ͷ���ϸ���еĴ�������c��________��
��2�����������ᷢ����ˮ���Ϸ�Ӧʱ��������________��________����ͼ�����ڵĽṹ��ʽ��________��
��3��b�ṹ�Ķ����Ծ����书�ܵĶ����ԣ�����Ϊ�ṹ���ʡ��������ʡ�________��________���������ʵȡ�
��4��SARS�������Ŵ���Ϣ������e�У�e���ʳ���ˮ��IJ�����______________����С��Ҷ��ϸ���У�e��Ҫ������________�С�
��5��d�й�������Ĥ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ϳ���ȼ�շ�ȷ���л������ɡ���ͼ����ȼ�շ�ȷ���л��ﻯѧʽ���õ�װ�ã��÷������ڵ�¯����ʱ�ô�������������Ʒ�����ݲ��������ȷ���л������ɡ�

�ش��������⣺
��1��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ______________________________________��
��2��Cװ��(ȼ�չ�)��CuO��������_______________________________________��
��3��д��Eװ������ʢ���Լ�������_____________��
��4����4.6 g�л���M����ʵ�飬�������5.4 g H2O��8.8 g CO2��������ʵ�ʵ��ʽ��________��
��5�����ⶨ���л���M�ĺ˴Ź�������ʾ��ͼ��ͼ����M�Ľṹ��ʽΪ_____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ,��0.100mol/L��NaOH��Һ�ζ�20.00mL0.100mol/L��HA��Һ����Һ��PH������NaOH��Һ���(V)�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
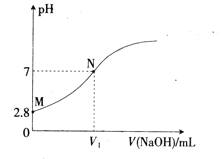
A. V1<20
B. Ka(HA)��������Ϊ10-5
C. M����Һ������ˮϡ��,c(H+)/c(A-)����
D. N�������NaOH��Һ�ļ���,��Һ��ˮ�ĵ���̶�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ���������װ��С�ɡ���ȫ�ɿ���������Ⱦ���ص�����㷺Ӧ�ã�������ԭ����ҵԭ����ͬ��ͼ����ʾ��ʵ�����н���NH3�Ĵ�����ʵ���װ��(�����ڲ�����ά�ϵ�Cr2O3������)��ͼ�е�����̨���ƾ��Ƶ��Ѿ���ȥ������ѧҩƷ�����ȡ��(�����ܰ���ʵ����������������)������

��1����A�в�������������HCl ����ð�������������еĹ�������A��_______�� B ��_______��
(��������A��B������һ������Ҳ�����Ƕ������ʵĻ����)
��2��C������ ��Ӧ�Ļ�ѧ����ʽΪ______________���÷�Ӧ�л�ԭ����_______���ڹ�ҵ �ϣ��÷�ӦҪ������_______(��������) ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com