
【题目】下面是生物体细胞内部分有机化合物的概念图,请回答下列问题。
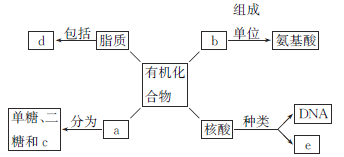
(1)小麦种子中的储能物质c是________,人和动物细胞中的储能物质c是________。
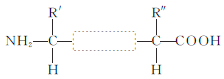
(2)两个氨基酸发生脱水缩合反应时,产物是________和________,下图方框内的结构简式是________。
(3)b结构的多样性决定其功能的多样性,如作为结构物质、防御物质、________、________、调控物质等。
(4)SARS病毒的遗传信息贮存在e中,e物质初步水解的产物是______________;在小麦叶肉细胞中,e主要存在于________中。
(5)d中构成生物膜的是____________。
【答案】淀粉 糖原 H2O 二肽 —CO—NH— 催化物质(催化或酶) 运输物质(运输或载体) 核糖核苷酸 细胞质 磷脂
【解析】
据图分析,图1中a是糖类,b是蛋白质,c是多糖,d是脂肪、磷脂和固醇,e是RNA;图2表示两个氨基酸脱水缩合形成的二肽,其中虚框内表示的是肽键,其结构式为-CO-NH-。
(1)根据以上分析已知,c表示多糖,植物细胞中储存能量的多糖是淀粉;人和动物细胞中的储存能量的多糖是糖原。
(2)两个氨基酸通过脱水缩合形成二肽和水,形成的化学键是虚框内的肽键,分子式为-CO-NH-。
(3)根据以上分析已知,b表示蛋白质,蛋白质结构的多样性决定了其功能的多样性,如作为结构物质、免疫物质、催化物质、运输物质、调节物质等。
(4)根据以上分析已知,e是RNA,其基本单位是核糖核苷酸;小麦细胞中,RNA主要存在于细胞质中。
(5)根据以上分析已知,d表示脂肪、磷脂和固醇,其中磷脂是构成生物膜的主要成分之一。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解
④ 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 mL ,量取浓硫酸所用的量筒的规格是 。
(从下列中选用 A. 10mL B. 25mL C. 50mL D. 100ml)
(2)第③步实验的操作是
。
(3)第⑤步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的液凹面
查看答案和解析>>
科目:高中化学 来源: 题型:
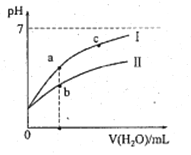
【题目】下表为25℃时某些弱酸的电离平衡常数;下边图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
弱酸的电离平衡常数(25℃) | |
CH3COOH | HClO |
Ka=1.8×10-5 | Ka=3.0×10-8 |
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH-)+c(CH3COO-)>NaClO溶液的c(OH-)+c(C1O-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,其中X、Z同主族,Y原子的最外层电子数为次外层电子数的一半,X原子的最外层电子数是其核外电子层数的3倍。下列说法不正确的是
A. 最简单气态氢化物的热稳定性,W>Z>Y B. 单质的沸点:Y>X>Z
C. 简单离子半径:Z>W>X D. X的氢化物中可能含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
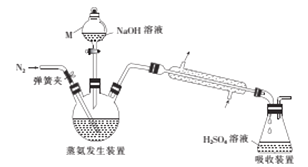
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。

(1)图一是根据反应Zn + CuSO4 == Cu + ZnSO4 设计成的锌铜原电池。Cu极的电极反应式是________________________________________,盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向_______移动(填“甲”或“乙”)。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应式是__________________________________________;当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为________________L。
(3)一段时间后,燃料电池的电解质溶液完全转化为K2CO3,以下关系正确的是______________。
A.c(K+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(K+)>c(CO32-)>c(H+)>c(OH-)
D.c(K+)>c(CO32-)>c(OH-)>c(HCO3-)
E.c(K+)= 2c(CO32-)+ c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W 在工业上常用作溶剂和香料,其合成方法如下:
![]()
下列说法正确的是
A. N、W 互为同系物
B. M、N、W 均能发生加成反应和取代反应
C. W 能发生皂化反应
D. M 的二氯代物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118,质量数为293的新元素,则该元素原子核内的中子数和核外电子数之差为
A.57B.47C.61D.175
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com