
【题目】用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是
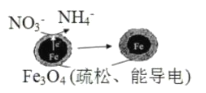
A.能量转化形式主要为化学能转化为电能
B.该原理的总反应可表示为NO3-+3Fe+2H++H2O=NH4++Fe3O4
C.电极材料分别为Fe和Fe3O4
D.负极反应为NO3-+8e-+10H+=NH4++3H2O
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g) + O2(g)![]() TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
TiO2(s) + 2Cl2(g) ΔH =-175.4 kJ/mol
Ⅱ.2C(s) + O2(g) ![]() 2CO(g) ΔH =-220.9 kJ/mol
2CO(g) ΔH =-220.9 kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g)![]() TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
TiO2(s)+2C(s)+2Cl2(g) 的ΔH =____________ kJ/mol
(2)toC时,向10L恒容密闭容器中充入1mol TiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
① 反应4min末的平均速率v(Cl2)=_____,该温度下K =____(用分数表示),O2的平衡转化率=_______.
② 下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是________
A.缩小容器的体积 B.加入催化剂 C.分离出部分TiO2
D.增加O2的浓度 E.减低温度 F.以上方法均不可以
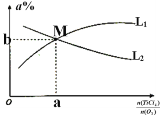
③toC时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图所示:能表示O2的平衡转化率的曲线为_________ (填“L1”或“L2”)M点的坐标为______________(用整数或分数表示)
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c(NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
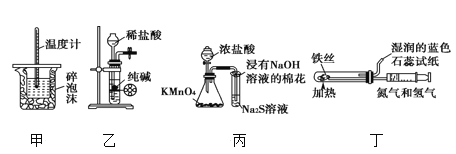
A. 用装置甲进行中和热的测定
B. 用装置乙制取 CO2 气体
C. 用装置丙比较KMnO4、Cl2、S的氧化性强弱
D. 用装置丁模拟工业制氨气并检验产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 广泛用作有机反应催化剂。十堰市采用镁屑与液溴为原料制备无水
广泛用作有机反应催化剂。十堰市采用镁屑与液溴为原料制备无水![]() ,装置如图1,主要步骤如下:
,装置如图1,主要步骤如下:
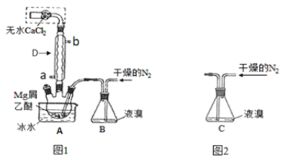
步骤1:三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三口瓶中。
步骤3:反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水![]() 产品。
产品。
已知:①![]() 和
和![]() 剧烈反应,放出大量的热;
剧烈反应,放出大量的热;![]() 具有强吸水性;
具有强吸水性;
②乙醚![]() 极易挥发;
极易挥发;
③![]()
![]()
请回答下列问题:
(1)仪器D的作用是__________;
(2)无水![]() 的作用是__________。
的作用是__________。
(3)步骤2通入干燥的![]() 的目的是______;实验中不能用干燥空气代替干燥
的目的是______;实验中不能用干燥空气代替干燥![]() ,原因是________。
,原因是________。
(4)若将装置B改为装置C(图2),可能会导致的后果是______
(5)步骤4用苯溶解粗品的目的是_________。
(6)从平衡移动的角度解释得到三乙醚合溴化镁后,加热有利于得到无水![]() 产品的原因:_________
产品的原因:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据叙述,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇(液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为______________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其热化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。

(1)写出元素A的名称:______________,C在元素周期表中的位置是______________。
(2)B的原子结构示意图为______________,C的氢化物与B的氢化物的稳定性强弱顺序为______________。
(3)比较A、C的原子半径:A______________(填“>”或“<”)C。写出A的气态氢化物与A的最高价氧化物对应的水化物反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C分别是三种有机物的结构模型:
A.![]() B.
B.![]() C.
C.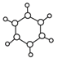
请回答下列问题:
(1)A和氯气在光照条件下发生反应的装置如图所示。
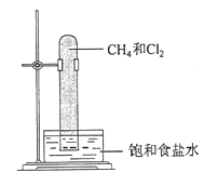
实验中可以观察到试管内壁上出现_____________;写出甲烷和氯气发生取代反应生成气态有机物的化学方程式_____________。
(2)A、B、C三种有机物中,所有原子均共面的有_____________(填结构简式)。
(3)等质量的以上三种物质完全燃烧时耗去O2的量最多的是_____________(填结构简式)。
(4)有机物C具有的结构或性质是_____________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构b.有毒、不溶于水、密度比水小
c.不能使酸性KMnO4溶液褪色d.一定条件下能与氢气或氧气反应
(5)已知C的同分异构体有多种,其中一种为![]() ,其一氯代物的同分异构体有________种。
,其一氯代物的同分异构体有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是( )

A.电池的负极反应为:Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是:Mg+H2O2+2H+===Mg2++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com