
����Ŀ��ij��ɫ��Һ��ֻ���ܺ������������е������֣�����ˮ���������H����OH������H+��NH4����K����Mg2����Fe3+��Al3����NO3һ��CO32һ��SO42������ȡ����100 mL��Һ��������ʵ�飺
�� ��һ�ݼ�����AgNO3��Һ���а�ɫ����������
�� �ڶ��ݼ�����BaCl2��Һ���а�ɫ������������ϴ�ӡ������������Ϊ4.66 g��
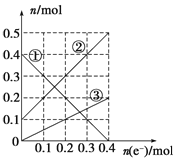
�� ��������εμ�NaOH��Һ����ó�����NaOH��Һ�������ϵ����ͼ��
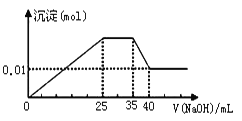
��������ʵ�飬�����Ʋ�����ȷ������ ��
A�����ݵ���غ㣬ԭ��Һ��NO3�������ʵ���ӦΪ0.03 mol
B��ԭ��Һһ��������H����Fe3����CO32��
C��ԭ��Һȷ����Mg2����Al3����NH4������n(Mg2��)��n(Al3��)��n( NH4��) = 1��1��2
D��ʵ�����ӵ�NaOH��Ũ��Ϊ2 mol��L��1
���𰸡�A
��������
���������D����ʵ������ͼ���֪������Һ�в���H+������Al3����Mg2����NH4����������NaOH�Ⱥ����ķ�Ӧ˳��Ϊ��Al3�� + 3 OH�� = Al(OH)3����Mg2�� + 2 OH�� = Mg(OH)2����NH4�� + OH�� = NH3�� + H2O��Al(OH)3 + OH�� = AlO2�� + 2 H2O����ȫ����Al3��������OH����NaOH�����ʵ�������ȫ�ܽ�Al(OH)3������3����ͼ����ȫ�ܽ�Al(OH)3����������NaOH��Һ�����Ϊ��40-35��mL=5mL������ȫ����Al3��������NaOH��Һ�����Ϊ5 mL��3=15 mL������ȫ��ȫ����Mg2��ʱ������NaOH��Һ�����Ϊ��25-15�� mL=10 mL����ͼ��֪��Mg(OH)2Ϊ0.01 mol�����ԭ��Һ��0.01 mol Mg2��������ȫ����ʱ��Ҫ����0.02 mol OH����NaOH����n/V=c��֪����NaOH��Ũ��Ϊ0.02 mol ��10 �� 10��3L = 2 mol��L��1��D����C����cV=n��֪����ȫ����Al3��������OH����NaOHΪ2 mol��L��1��15 �� 10��3L = 0.03 mol����Al3�� + 3 OH�� = Al(OH)3����֪��ԭ��Һ��Al3��Ϊ0.01mol����ȫ����NH4������OH����NaOHΪ2 mol��L��1��(35-25)�� 10��3L = 0.02 mol����NH4�� + OH�� = NH3�� + H2O��֪��ԭ��ҺNH4��Ϊ0.02 mol����n(Mg2��)��n(Al3��)��n( NH4��)=0.01 ��0.01 ��0.02 = 1��1��2��C��ȷ��B����ɫ��Һ�����ڻ�ɫ��Fe3��������Mg2����Al3������������CO32���������ܷ���˫ˮ�ⷴӦ��B��ȷ��A����ʵ������֪��ԭ��Һ����SO42������SO42�� + Ba2+ = BaSO4����m/M=n��֪��BaSO4Ϊ4.66 g �� 233 g/mol=0.02 mol����ԭ��Һ��0.02 mol SO42����n(�����) = 3 n(Al3��) + 2 n(Mg2��) + n(NH4��) = 0.01mol��3 + 0.01mol��2 + 0.02mol��1=0.07 mol��n(�����) = 2n(SO42��) = 0.02 mol��2 = 0.04 mol�����ݵ���غ��֪ԭ��Һ�к�NO3���������ڿ��ܻ�����K+�����NO3������Ӧ��0.03mol��A��������ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ���ǣ� ��
������ͭ��Һ������������Һ��Ӧ:Ba2++SO42-=BaSO4 ��
���������Ƽ���ˮ��2Na+2H2O=2Na+ +2OH-+H2��
��ʯ��ʯ����ϡ����:CaCO3+2CH3COO H=2CH3COO- +Ca2+ +CO2��+H2O
��������ˮ��Ӧ:Cl2��H2O![]() H����Cl����HClO
H����Cl����HClO
��С�մ���Һ�м�������ʯ��ˮ:Ca2++ 2OH-+2HCO3-=CaCO3��+CO32-+2H2O
�����������Һ��ͨ�����CO2:Ca2++2C1O-+CO2+H2O=CaCO3��+2HC1O
����������ͭ��Һ��Ӧ:Cu2+ +2Na=Cu+2Na+
��������Һ�еμ���������:CO32-+H+=HCO3-
A���٢ڢ� B���ڢۢܢݢ� C���ܢݢޢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء������й�˵����ȷ����
A. ��ѧΣ��Ʒ��Σ�����࣬Ӧ��ֹ����
B. ����β����Ŀǰ���д�����Ⱦ������һ����Ҫ��Դ
C. �������ƺ���������������������θ�����
D. Ư�۳��ڷ����ڿ����в������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;˵������ȷ����
A. FeCl3������ˮ����������ˮ��
B. ���ǰ뵼����ϣ������Ĺ��ǹ�����Ʒ�Ļ���ԭ��
C. Ũ�����ܸ���������˵��Ũ���������ˮ��
D. ����Һ����Һ���������մ������ȣ�����Һ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����ɫ����ζ�����Ҳ���ȼ�����壬�ڰ뵼��ӹ���̫���ܵ�������Һ����ʾ�������еõ��㷺Ӧ�ã�NF3��һ�������ͷ��ӣ�����102�����е���129��������ͭ�Ĵ���������F2����NH3��Ӧ�õ���
��1��д���Ʊ� NF3�Ļ�ѧ��Ӧ����ʽ�� ��
��2��NF3�ķе��NH3�ķе㣨��33�����͵ö����Ҫԭ���� ��
��3��NF3��NԪ�ز�ȡ ��ʽ�ӻ���
��4��������HF��NaAlO2��NaCl��6��1��2�����ʵ���֮��ǡ�÷�Ӧ����HCl��H2O��һ������ˮ����Ҫԭ�ϣ������ʺ�������Ԫ�أ�������ʵĻ�ѧʽΪ �����������ǣ���λ��Ϊ ��
��5����֪����Ԫ�أ���O����S����Se����Te������ҵ�Ͽ���Al2Te3���Ʊ�H2Te��������л�ѧ����ʽ��
Al2Te3+ �T Al��OH��3��+ H2Te��
��6����֪�ڳ����£�����17g H2S�ų�56.1KJ����������д������ֽ���Ȼ�ѧ����ʽ ��
��7����ͼ��ʾΪ����Ԫ�ص�����H2��Ӧ�����е������仯ʾ��ͼ������a��b��c��d�ֱ��ʾ������ijһԪ�صĵ��ʣ���HΪ��ͬ���ʵ����ĵ�����H2��Ӧ�ķ�Ӧ�ȣ���b���� ��d���� ����д�������ƣ���
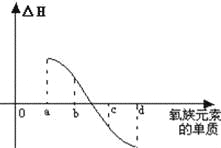
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������Ϳ���������أ�����˵���������
A. �ò����ͽ��ݻ����Ƶû����͵Ĺ���δ������ѧ�仯
B. ��ˮ�����������ʺ��к�ϸ����������������ɱ�����������
C. �����ݹ�KMnO4��Һ�Ĺ���������ˮ���������ӳ�ˮ���ı�����
D. ��ҽ����е��������ʱ���������������ȱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ص�ԭ�ӽṹ���������ʺ����ڱ��е�λ�ã�����˵����ȷ���ǣ� ��
A. Ԫ��ԭ�ӵ���������������Ԫ�ص�����ϼ�
B. �����ԭ���У�����˽Ͻ����������˶��ĵ��ӵ������ϸ�
C. P��S��Cl�õ�������������������Ӧˮ��������Ծ�������ǿ
D. Ԫ�����ڱ���λ�ڽ����ͷǽ����ֽ��߸�����Ԫ�����ڹ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��K�������ĸ����ʶ�����ѧ��ѧ�ﳣ�������ʣ���I�Ǿ��д��Ե����ʣ�D��K���������ԡ�һ�������£������ʼ�����Ӧת����ϵ����ͼ��ʾ��
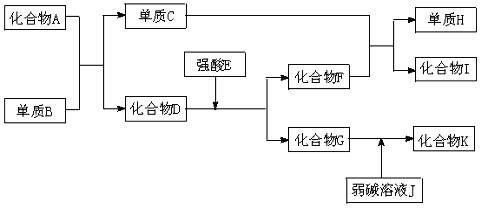
��ش�
��1��д���й����ʻ�ѧʽ��D�� ��H�� ��
��2��д�����з�Ӧ�ķ���ʽ��
��������G����Һ�� �����ԣ����ԣ����ԣ�����ԭ�������ӷ���ʽ��ʾΪ
��д��C��F![]() H��I�Ļ�ѧ����ʽ���õ����ű�ʾ��Ӧ�����е���ת�Ƶķ������Ŀ ��
H��I�Ļ�ѧ����ʽ���õ����ű�ʾ��Ӧ�����е���ת�Ƶķ������Ŀ ��
��G��J![]() K�����ӷ���ʽ��ʾΪ ��
K�����ӷ���ʽ��ʾΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ļ���ԭ�Ϻ�����ȼ�ϡ�
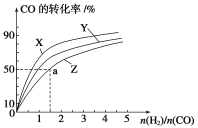
(1)��ҵ��һ����CO��H2Ϊԭ�����ܱ������кϳɼ״���CO(g)��2H2(g)![]() CH3OH(g)����H����90.8 kJ��mol��1�����ݻ�Ϊ1 L�ĺ��������У��ֱ��о���230 ����250 ����270 �������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶���H2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ��������Z��Ӧ���¶���________�����¶���������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________��
CH3OH(g)����H����90.8 kJ��mol��1�����ݻ�Ϊ1 L�ĺ��������У��ֱ��о���230 ����250 ����270 �������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶���H2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ��������Z��Ӧ���¶���________�����¶���������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________��
(2)��ͼ�Ǽ״�ȼ�ϵ�ع�����ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��

I.���и����ĵ缫��ӦʽΪ_________ _______
II�����з�Ӧ�Ļ�ѧ����ʽΪ______ __ ________��A�������������ڱ�״���µ����Ϊ________________��
III����װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ����ͼ����ͼ�Т��߱�ʾ����________�ı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������Ҫ________ mL 5.0 mol��L��1 NaOH��Һ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com