
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
分析 短周期元素中,W只有-2价,则W为O元素,Z有+6、+4、-2价,原子半径大于O元素,二者应同主族,故Z为S元素;X、Y的化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径与O相差很大,应处于第三周期,故X为Mg、Y为Al,结合元素单质化合物的性质及元素周期律进行解答.
解答 解:A.同周期自左而右金属性减弱,故金属性Mg>Al,故A错误;
B.一定条件下,硫与氧气反应可以生成二氧化硫,故B错误;
C.氧化铝对应的水化物氢氧化铝是一种是弱酸,故C错误;
D.一定条件下,氧气与氨气反应可以生成氮气与水,故D正确;
故选:D.
点评 本题考查结构性质位置关系应用,难度中等,根据化合价及原子半径推断元素是解题关键,注意对元素周期律及元素化合物性质的理解掌握.


科目:高中化学 来源: 题型:解答题
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |
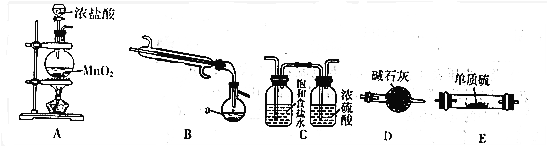
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
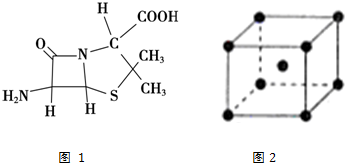
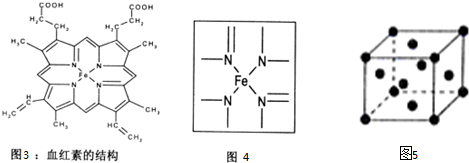
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
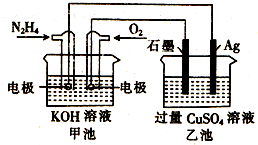
| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池中负极反应为N2H4-4e-=N2+4H+ | |
| C. | 甲池和乙池中的溶液的pH均减小 | |
| D. | 当甲池中消耗0.1mol N2H4时,乙池中理论上最多产生6.4g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的数值是2 | |
| B. | A的转化率为50% | |
| C. | B的平衡浓度为2mol/L | |
| D. | 反应前后混合气体的压强之比为22:25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 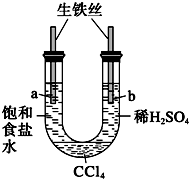 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 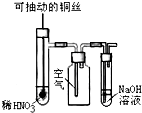 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 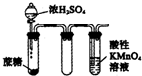 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 往蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热,能看到银镜生成 | |
| C. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| D. | 向鸡蛋清溶液中加硫酸铵饱和溶液,有沉淀析出,再加水沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
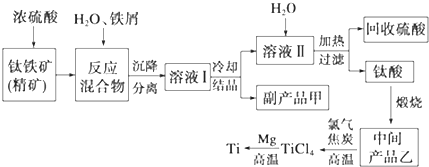
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲中试剂 | 乙中试剂 | 气体成份及实验目的 | 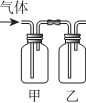 |
| A | NaHSO3溶液 | 硅酸钠溶液 | HCl:证明非金属Cl>S>Si | |
| B | FeI2淀粉溶液 | FeI2、KSCN溶液 | Cl2:验证氧化性Cl2>Fe3+>I2 | |
| C | 溴水 | AgNO3溶液 | 乙烯:验证溴水与乙烯发生的是加成反应 | |
| D | Ba(OH)2溶液 | 品红溶液 | 验证混合气体中含有SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com