
(11分)某化学兴趣小组拟用下图装置测定某粗锌样品中锌的质量分数。他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应。请填写以下实验报告。
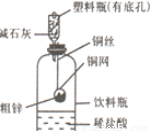
(1)实验目的: ;
(2)实验步骤:
①称取10.0 g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0 g。
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为 ;
③反应完全后,称得装置总质量为119.8 g,则粗锌中锌的质量分数为 ;
(3)问题探究:(已知碱石灰是NaOH和CaO的混合物,常用于干燥、吸收气体。)
①该实验若不用碱石灰,则所测得的粗锌中锌的质量分数将 ;(填“偏大”、“偏小”或“无影响”)。
②若将粗锌换成某含有杂质的石灰石样品(杂质也不与稀盐酸反应),判断该实验方案能不能用于石灰石样品中CaCO3质量分数的测定,并说明理由。
。
(1)测定粗锌样品中锌的质量分数(或纯度)(2分);
(2)②Zn+2HCl=ZnCl2+H2↑(2分);③ 65%(2分);
(3)①偏大(2分);② 不能,碱石灰能吸收反应生成的CO2(3分,判断1分,理由2分)。
【解析】
试题分析:(1)根据题意可知该实验的所以目的是测定粗锌样品中锌的质量分数;
(2)由于粗锌中的杂质不与稀盐酸反应,Cu也不与稀盐酸反应,所以发生的反应只有Zn与稀盐酸的反应,化学方程式为Zn+2HCl=ZnCl2+H2↑;原装置的总质量是120.0g,反应完全后变为119.8g,说明产生的氢气的质量是120.0-119.8=0.2g,其物质的量是0.1mol,则参加反应的Zn的物质的量是0.1mol,质量是0.1mol×65g/mol=6.5g,所以粗锌中锌的质量分数是6.5g/10.0g×100%=65%;
(3)①若该实验中不用碱石灰,则放出的氢气会带走部分的水蒸气,造成反应完全后整个装置的质量减少,即反应前后装置的质量差偏大,产生的氢气偏多,所以所测得的粗锌中锌的质量分数将偏大;
②若将粗锌换成某含有杂质的石灰石样品,由于石灰石与盐酸反应产生二氧化碳气体,碱石灰也能吸收二氧化碳,不能确定氢气的质量,所以不能测定粗锌中锌的质量分数,因此不能将粗锌换成某含有杂质的石灰石样品。
考点:考查学生的分析思维能力,对实验误差的分析,质量分数的计算


科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:选择题
以下离子①H+、②Cl-、③Al3+、④K+、⑤SO42—、⑥OH-、⑦NO3—、⑧NH中,基本上不影响水的电离平衡的是
A.①③⑤⑦⑧ B.②④⑥⑦ C.②④⑤⑦ D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省高二上学期半期考试化学试卷(解析版) 题型:填空题
(14分)I.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.5mol液态肼和1mol H2O2混合反应,生成氮气和水蒸气,放出256.5kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44.0kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
II.已知: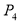 (s,白磷)+
(s,白磷)+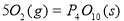
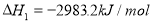
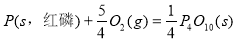
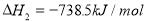
则白磷转化为红磷为____________反应(填“吸热”或“放热”);白磷的稳定性比红磷___________(填“高”或“低”)。
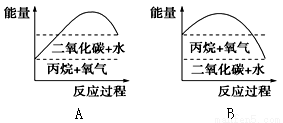
III.能较准确地反映丙烷燃烧时能量变化的曲线是________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第一次月考化学试卷(解析版) 题型:选择题
如图由锌—铜—稀H2SO4组成的原电池装置中,当导线中有0.2 mol电子通过时,理论上两极的变化是( )

A.铜片增重6.4g B.锌片增重6.5 g
C.铜片上析出0.1 mol O2 D.锌片溶解了6.5 g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学腐蚀 ⑤电泳
A.①② B.②③⑤ C.②③ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,18g水中含有NA个氢原子
B.一个水分子的质量是18/NAg
C.标准状况下,11.2L水所含分子数为0.5 NA
D.含有原子总数为0.1NA的水的质量为1.8g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列各物质中所含有的分子数最多的是
A.标准状况下11.2 L氯气B.17g氨气(NH3)
C.1.204×1024个H2O分子 D.0. 8mol氧气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:选择题
工业制硫酸的第一步反应,可用化学方程式表示如下:4FeS2+11O2=2Fe2O3+8SO2
对此反应下列说法中正确的是()
A.FeS2既是氧化剂又是还原剂
B.O2只做氧化剂
C.氧化产物只有Fe2O3
D.4molFeS2发生反应时,反应中共有22mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省宝鸡市岐山县高一上学期期中质量检测化学试卷(解析版) 题型:填空题
(10分)(1)写出下列反应的离子方程式:
①氯化铵溶液和氢氧化钠溶液反应 ;
②少量二氧化碳通入澄清石灰水 ;
③三氧化二铁和盐酸反应 。
(2)铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_________剂,具有 性。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生 反应;浓H2SO4作_________剂,具有 性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com