
【题目】(安徽屯溪一中2016届月考)今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:

其推断正确的是 ( )
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | CO2 |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是

A.“彩雾”是一种混合物
B.上述过程中有物理变化
C.燃料燃烧产生的热量促使拉烟剂气化
D.“彩雾”的形成与焰色反应的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。

①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
A.容器内气体颜色不再变化 B.v正(NO)=2 v正(O2)
C.气体平均摩尔质量在此条件下达到最大 D.容器内气体密度不再变化
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g) △H= 。
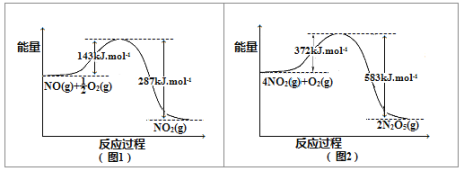

(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1中的△H1>△H2
B. 对于可逆反应A(s)+3B(g)![]() 2C(g) △H>0,压强对平衡常数K的影响符合图2
2C(g) △H>0,压强对平衡常数K的影响符合图2
C. 图3表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系
D. 由图4可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。

完成下列各题:
(1)正四面体烷的分子式为___________,其二氯取代产物有__________种。
(2)关于乙烯基乙炔分子的说法错误的是__________
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各小题。
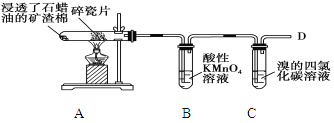
(1)碎瓷片的作用是_____________。
(2)B中现象是________,乙烯发生_______反应。
(3)C中现象是________,发生反应的化学方程式______________________。
(4)在D处点燃时必须进行的操作是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下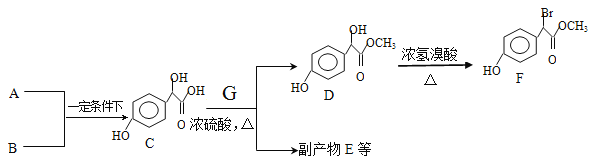
(1)根据流程图分析出G的命名 ,写出C和G反应生成D的反应方程式 。
(2)已知B为苯酚,A和B反应生成C的反应是加成反应。A可发生银镜反应,且具有酸性,则A的分子式为:_________。
(3)E是由2分子C生成的含有3个六元环的化合物,写出E的结构简式________。
(4)D→F的反应类型是__________,写出D→F的化学反应方程式 。
(5)符合下列条件的F的所有同分异构体(不考虑立体异构)的结构有 种。
①、属于一元酸类化合物,②、苯环上只有2个取代基且处于对位,其中一个是羟基
(6)A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
合成路线的第一步已经写出,请在下面框中完成后续的合成路线流程图
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应2NO2+2NaOH═NaNO3+NaNO2+H2O,含0.2mol NaOH水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1)可使溶液A和溶液B的pH值相等的方法是 。
a、向溶液A中加适量水 b、向溶液A中加适量NaOH
c、向溶液B中加适量水 d、向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:

(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com