
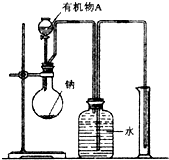
 26.4g某液态有机化合物A完全燃烧后,生成21.6g H2O和52.8gCO2.测得有机化合物A的蒸气对H2的相对密度是44,求:
26.4g某液态有机化合物A完全燃烧后,生成21.6g H2O和52.8gCO2.测得有机化合物A的蒸气对H2的相对密度是44,求:| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
| x |
| 2 |
| m |
| M |
| V |
| Vm |
| m |
| V |
| M |
| Vm |
| 26.4g |
| 88g/mol |
| 21.6g |
| 18g/mol |
| 52.8g |
| 44g/mol |
| 9.6g |
| 16g/mol |
| aρg |
| 88g/mol |
| aρ |
| 88 |
| b×10-3 |
| 22.4 |
| x |
| 2 |
| x |
| 2 |
| aρ |
| 88 |
| b×10-3 |
| 22.4 |
| 2×88b |
| 22.4aρ×1000 |
| 2×88b |
| 22.4aρ×1000 |
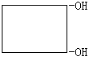 或
或 ,核磁共振氢谱显示有机物A有3种吸收峰,且峰面积之比为1:1:2,则该有机物可以是:OHCH2CH=CHCH2OH,若b=0,则x=0,且A具有果香味,那么A为丁酯,则A可以是乙酸乙酯或甲酸正丙酯和甲酸异丙酯,即有3种,故答案为:3;OHCH2CH=CHCH2OH;3;
,核磁共振氢谱显示有机物A有3种吸收峰,且峰面积之比为1:1:2,则该有机物可以是:OHCH2CH=CHCH2OH,若b=0,则x=0,且A具有果香味,那么A为丁酯,则A可以是乙酸乙酯或甲酸正丙酯和甲酸异丙酯,即有3种,故答案为:3;OHCH2CH=CHCH2OH;3; 

科目:高中化学 来源: 题型:
| A、NO2和H2O反应生成HNO3 |
| B、N2和O2经放电生成NO |
| C、通过加压、降温等方法将氮气转变为液态氮 |
| D、NH3被H2SO4硫酸吸收生成(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “嫦娥一号”的登月成功,实现了中国人“奔月”的梦想
“嫦娥一号”的登月成功,实现了中国人“奔月”的梦想查看答案和解析>>
科目:高中化学 来源: 题型:
 已知,利用排空气法收集气体,使体积为VL的圆底烧瓶内充满干燥纯净的某种(可能多种)气体.胶头滴管内和烧杯中均盛有水.在标准状况下,进行喷泉实验,均求实验后所得溶液中溶质的物质的量浓度是多少?(有详细过程)
已知,利用排空气法收集气体,使体积为VL的圆底烧瓶内充满干燥纯净的某种(可能多种)气体.胶头滴管内和烧杯中均盛有水.在标准状况下,进行喷泉实验,均求实验后所得溶液中溶质的物质的量浓度是多少?(有详细过程)查看答案和解析>>
科目:高中化学 来源: 题型:

| A、pH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B、当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 |
| C、当V(NaOH)=30mL时,溶液中 c(SO42-)+c(H+)═c(NH3?H2O)+c(OH-) |
| D、滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置(1)用于分离沸点不同的两种液态有机物,装置(4)适用实验室制取少量乙酸乙酯 |
| B、装置(2)可用于检验碳酸钠与碳酸氢钠两种固体 |
| C、装置(3)可用于CO还原氧化铁实验 |
| D、装置(5)选择合适药品时,可用于制备少量氨气及氧气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:
,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com