
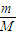 计算镁离子的物质的量,A、硫酸镁的物质的量等于镁离子物质的量,根据m=nM计算硫酸镁的质量,利用质量分数定义计算;
计算镁离子的物质的量,A、硫酸镁的物质的量等于镁离子物质的量,根据m=nM计算硫酸镁的质量,利用质量分数定义计算;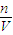 计算硫酸镁的物质的量浓度;
计算硫酸镁的物质的量浓度; 计算水的物质的量,据此计算;
计算水的物质的量,据此计算;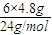 =1.2mol,
=1.2mol,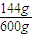 ×100%=24%,故A错误;
×100%=24%,故A错误;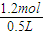 =2.4mol/L,故B正确;
=2.4mol/L,故B正确;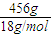 =
=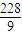 mol,故硫酸镁与水的物质的量之比为1.2mol:
mol,故硫酸镁与水的物质的量之比为1.2mol: mol≈1:21.1,故C正确;
mol≈1:21.1,故C正确;

科目:高中化学 来源:不详 题型:单选题
| A.溶质的质量分数是24.0% |
| B.溶液的物质的量浓度是2.4mol/L |
| C.溶质和溶剂的物质的量之比是1:40 |
| D.硫酸根离子的质量分数是19.2% |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省泰安市新泰市高三(上)月考化学试卷(10月份)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com