
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 溴乙烷与氢氧化钠溶液共热后加入硝酸银溶液 | 无浅黄色沉淀出现 | 溴乙烷未水解 |
| B | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫红色 | 碘在CCl4中的溶解度较大 |
| A、A | B、B | C、C | D、D |


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| A、水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 | ||||
| B、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | ||||
C、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,
| ||||
| D、室温下,CH3COOH的Kα=1.7×10-5,NH3?H2O的Kb=1.7×10-5,CH3COOH溶液中的c (H+)与NH3?H2O中的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、pOH=-lg
| ||
| C、c(H+)=10-pOH | ||
D、pH+pOH=lg
|
查看答案和解析>>
科目:高中化学 来源: 题型:
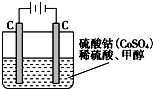
 如图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+?AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液.下列叙述中正确的是( )
如图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+?AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液.下列叙述中正确的是( )| A、甲组操作时,电流计(G)指针发生偏转 |
| B、甲组操作时,溶液颜色变浅 |
| C、乙组操作时,C2做正极 |
| D、乙组操作时,C1上发生的电极反应为I2+2e-═2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与铝反应放出氢气的溶液中:K+、Al3+、Cl-、SO42- |
| B、水电离出来的c(H+)=10-12mol/L的溶液 Na+、Cl-、Br-、Ba2+ |
| C、所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
| D、室温下,pH=1的无色溶液中:Na+、Fe3+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入少量的CH3COONa |
| B、向水中加入少量的NaHSO4 |
| C、向水中加入NaI并加热至100℃,pH=6 |
| D、向水中加少量的KAl(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
| SrSO4 | BaSO4 | Sr(OH)2 | |
| KSP | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | 4.13 | 5.50 | 7.00 | 8.00 | 9.00 | 10.10 | 11.20 | 13.20 |
| V(O2)/mL | 9.0 | 90 | 467 | 595 | 639 | 550 | 500 | 455 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金材料中可能含有非金属元素 |
| B、人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
| C、人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D、柠檬、桔子等虽然是具有酸味的水果,但属于碱性食物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com