
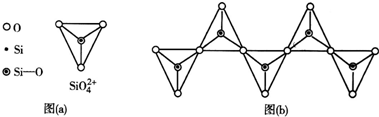
分析 (1)硅质子数为14,基态Si原子的核外电子排布式为1s22s22p63s23p2,最高能层具有的原子轨道数为1+3+5=9;电子数为4;
(2)单质硅存在与金刚石结构类似的晶体,其晶体类型为原子晶体;利用均摊法计算;
(3)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2;
(4)根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32-.
解答 解:(1)硅质子数为14,基态Si原子的核外电子排布式为1s22s22p63s23p2,最高能层具有的原子轨道数为1+3+5=9;电子数为4,故答案为:1s22s22p63s23p2;9;4;
(2)单质硅存在与金刚石结构类似的晶体,其晶体类型为原子晶体,硅晶胞中每个顶点上有1个Si、面心是有1个Si、在晶胞内部含有4个Si原子,利用均摊法知,利用均摊法知,面心提供的硅原子个数=6×$\frac{1}{2}$=3,
故答案为:原子晶体;3;
(3)Mg2Si和NH4Cl在液氨介质中反应制得SiH4、NH3和MgCl2,方程式为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2,故答案为:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;(4)根据图(b)的一个结构单元中含有1个硅、2+2×$\frac{1}{2}$=3个氧原子,化学式为SiO32-,其中Si原子的杂化形式是sp3,
故答案为:sp3;1:3;SiO32-.
点评 本题以硅及其化合物为载体考查了晶胞的计算、等知识点,这些知识点都是考试热点,熟练掌握并灵活运用基础知识解答问题,易错点是(4).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
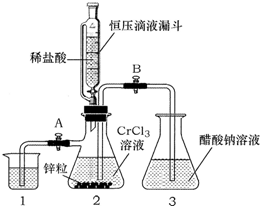 酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:
酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
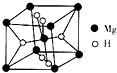 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
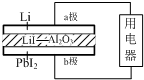 某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb.下列说法正确的是( )
某锂碘电池以LiI-Al2O3固体为电解质传递离子,其基本结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb.下列说法正确的是( )| A. | 电子由b极经用电器流向a极 | |
| B. | I-由a极通过固体电解质传递到b极 | |
| C. | b极上的电极反应式为:PbI2-2e-=Pb+2I- | |
| D. | b极质量减少1.27 g 时,a极转移的电子数约为6.02×1021 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
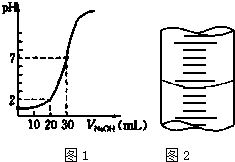 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com