
【题目】氰基烯酸酯在碱性条件下能快速聚合为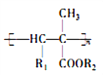 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
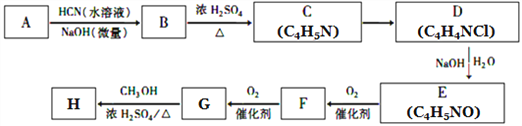
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;
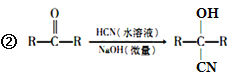
回答下列问题:
(1)A的化学名称为____________。
(2)C的结构简式为________________,F中的含氧官能团名称是________________。
(3)由E生成F的反应类型为_____________,由G生成H的反应类型为_____________。
(4)由G生成H的化学方程式为________________________________。
(5)写出A的能够发生银镜反应的同分异构体的结构简式______________。
【答案】 丙酮 ![]() 醛基 氧化反应 取代反应(酯化反应)
醛基 氧化反应 取代反应(酯化反应) ![]() + CH3OH
+ CH3OH ![]()
![]() + H2O CH3CH2CHO
+ H2O CH3CH2CHO
【解析】试题分析:(1)A的相对分子量为58,氧元素质量分数为0.276,则氧原子个数是58×0.276÷16=1,再根据商余法42÷12=3…6,A的分子式是C3H6O,核磁共振氢谱显示为单峰,A是CH3COCH3;(2)A是CH3COCH3,根据信息②,可知B是![]() ;B在浓硫酸作用下生成C,根据C的分子式C4H5N,可知C是
;B在浓硫酸作用下生成C,根据C的分子式C4H5N,可知C是![]() ;H是氰基丙烯酸酯,结合G在浓硫酸条件下与甲醇反应生成H,则H是
;H是氰基丙烯酸酯,结合G在浓硫酸条件下与甲醇反应生成H,则H是![]() ;逆推G是
;逆推G是![]() ;F是
;F是![]() ;E是
;E是![]() ;D是
;D是![]() 。
。
解析:根据以上分析,(1)A是CH3COCH3,化学名称为丙酮。
(2)C的结构简式为![]() ,F是
,F是![]() 含氧官能团是-CHO,名称是醛基。
含氧官能团是-CHO,名称是醛基。
(3)由![]() →
→![]() 的反应类型为氧化反应,
的反应类型为氧化反应,![]() 在浓硫酸条件下与甲醇反应生成
在浓硫酸条件下与甲醇反应生成![]() 的反应类型为酯化反应。
的反应类型为酯化反应。
(4)![]() 在浓硫酸条件下与甲醇反应生成
在浓硫酸条件下与甲醇反应生成![]() 的反应方程式为
的反应方程式为![]() + CH3OH
+ CH3OH ![]()
![]() + H2O。
+ H2O。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质)写出试剂或操作的名称、方法及有关的化学方程式或离子方程式:
(1)Fe2O3(Al2O3)_________________;离子方程式__________。
(2)Fe2O3[Fe(OH)3]________;化学方程式_______________。
(3)FeSO4溶液(CuSO4)_____________;离子方程式_________。
(4)FeCl3溶液(FeCl2)_____________;离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似.
A. ①②③ B. ②③ C. ③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三种溶液中NH4+的浓度:②>③>①>④
D. 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系,回答下列问题。

(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出反应⑧的化学方程式和反应④、⑤的离子方程式。
⑧_____________________________________________________;
④_____________________________________________________;
⑤_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有20mL浓度为0.04mol·L-1的Na2SO3溶液恰好与10mL浓度为0.02mol·L-1的K2A2O7溶液完全反应。已知Na2SO3可被K2A2O7氧化为Na2SO4,则元素A在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
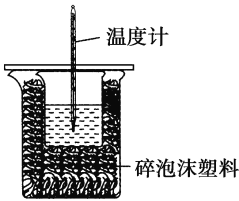
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:

已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、_____________________。
(2)操作Ⅰ的目的是_______________________和调节溶液的PH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是___________________________________________________________________。
(3)通过煅烧MnSO4·H2O可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余质量变化的曲线如图所示。根据图中数据可得MnxO4中x的值为______________。A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,写出该过程中发生反应的化学方程式:______________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com