
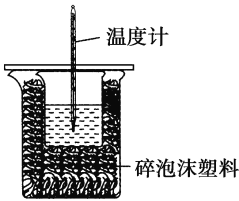
【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。
【答案】10.0环形玻璃搅拌棒让NaOH溶液完全反应保温、隔热,减少热量损失偏大醋酸在溶液中电离吸收热量,使测得的中和热(ΔH)偏大4.0HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
【解析】
(1)因为没有400 mL容量瓶,实际配制的是500 mL(0.5 L)溶液,即m(NaOH)=0.50 mol·L-1×0.5 L×40 g/mol=10.0 g;(2)为减少热量损失,需缩短反应时间,要搅拌,应用环形玻璃搅拌棒;(3)为确保NaOH完全反应,减少误差,盐酸需要过量,故答案为让NaOH完全反应;(4)它们的作用都是保温,隔热、减少热量损失;(5)因为醋酸电离会吸热,所以用醋酸测中和热,放出的热量比盐酸要少,ΔH偏大,故答案为:偏大、醋酸在溶液中电离吸收热量,使测得的中和热(ΔH)偏大;(6)四组数据计算的温差分别为4.0 ℃、6.1 ℃、3.9 ℃、4.1 ℃,明显第2组数据应舍去,所以平均温度差为4.0 ℃;(7)在该中和实验中,生成水的物质的量为0.05mol,放出的热量为2.865 kJ,则生成1mol水放出的热量为2.865kJ÷0.05mol=57.3 J·mol-1,则ΔH=-57.3 kJ·mol-1,故反应的中和热化学方程式为HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】请用下图所示仪器装置设计一个包括电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。
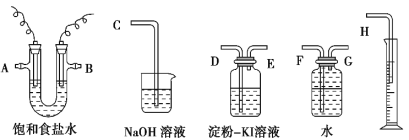
(1)所选仪器 连接时,各接口的顺序是(填各接口的代号字母):A 接 , 接 ,B 接 , 接 。_____________
(2)实 验 时 , 装 置 中 的 石 墨 电 极 接 电 源 的 _____极 , 所 发 生 的 电 极 反 应 式 为_____;铁电极接电源的_____极,所发生的电极反应式为_____; 此电解总反应方程式为_________。
(3)实验测得产生的氢气体积(已折算成标准状况)为 5.60 mL,电解后溶液的体积恰好为50.0 mL,则溶液中 OH-的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基烯酸酯在碱性条件下能快速聚合为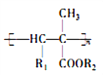 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
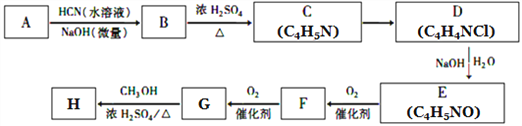
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;
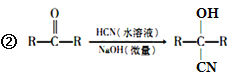
回答下列问题:
(1)A的化学名称为____________。
(2)C的结构简式为________________,F中的含氧官能团名称是________________。
(3)由E生成F的反应类型为_____________,由G生成H的反应类型为_____________。
(4)由G生成H的化学方程式为________________________________。
(5)写出A的能够发生银镜反应的同分异构体的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃与H2发生加成反应后得到的产物是CH3CH(CH3)2.
(1)该产物的系统命名的名称为______,写出该产物的同分异构体的结构简式______
(2)光照条件下,该产物与氯气反应,生成含两个甲基的一氯代物,写出反应的化学方程式______________________ ,反应类型是______________
(3)原来烯烃的结构简式为:______,系统命名的名称为______________
(4)写出该烯烃一定条件下发生加聚反应的方程式:_____________;
(5)写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式:____; 反应类型是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出两个可以生成H2的反应:①Zn+盐酸;②Na+水。为点燃经验纯后上述两个反应生成的H2,他们设计了图示装置。请回答下列问题:

(1)写出Na与H2O反应的化学方程式:__。
(2)实验小组在点燃用上述装置制得的H2时,实验①获得成功,实验②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是__。
(3)实验小组查阅资料知钠、煤油、水的密度分别为0.97 g·cm-3、0.8 g·cm-3、1.00 g·cm-3,并据此对实验进行改进,在改进后的实验中H2的生成速率减慢,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、醋酸和氨水是中学化学中常见的三种物质,某校实验小组利用浓盐酸、冰醋酸和浓氨水分别配制了浓度均为0.1 mol·L-1的三种溶液各100 mL并进行相关实验,据此回答下列问题:
(1)常温下上述三种溶液的PH由大到小的顺序是____________________。
(2)25℃时,利用pH试纸测得0.1 mol·L-1醋酸溶液的pH约为5,则可以估算出醋酸的电离常数约为__________________;向10 mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 的值将_________(填“增大”“减小”或“无法确定”)。
的值将_________(填“增大”“减小”或“无法确定”)。
(3)将浓度均为0.1 mol·L-1的盐酸和氨水等体积混合,则:①所得混合溶液显_______性(填“酸性”“碱性”或“中性”),原因是__________________(用离子方程式表示)。
②所得混合溶液中所有离子的物质的量浓度由大到小的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. KOH的摩尔质量是56g
B. 一个二氧化碳分子的质量就是其相对分子质量
C. 硫原子的摩尔质量就是硫的相对原子质量
D. 氦气的摩尔质量以克每摩尔为单位时在数值上等于它的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将铝粉分别加入下列溶液中,能放出氢气,且可能大量共存的是( )
A.H+、Ba2+、Cl﹣、NO3﹣
B.NH4+、CO3﹣、NO3﹣、Na+
C.NO3﹣、K+、[Al(OH)4]﹣、OH﹣
D.Na+、Ba2+、Mg2+、HCO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com