
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出两个可以生成H2的反应:①Zn+盐酸;②Na+水。为点燃经验纯后上述两个反应生成的H2,他们设计了图示装置。请回答下列问题:

(1)写出Na与H2O反应的化学方程式:__。
(2)实验小组在点燃用上述装置制得的H2时,实验①获得成功,实验②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是__。
(3)实验小组查阅资料知钠、煤油、水的密度分别为0.97 g·cm-3、0.8 g·cm-3、1.00 g·cm-3,并据此对实验进行改进,在改进后的实验中H2的生成速率减慢,原因是____。
【答案】 2Na+2H2O![]() 2NaOH+H2↑ 钠与水反应放出大量的热,会使试管内H2与O2的混合气体爆炸 钠比水轻,比煤油重,落在煤油与水的交界处。钠与H2O反应产生的H2使钠浮起,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,减慢了Na与H2O的反应速率
2NaOH+H2↑ 钠与水反应放出大量的热,会使试管内H2与O2的混合气体爆炸 钠比水轻,比煤油重,落在煤油与水的交界处。钠与H2O反应产生的H2使钠浮起,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,减慢了Na与H2O的反应速率
【解析】本题考查实验方案设计与评价,(1)钠是活泼金属,能与水发生反应,反应方程式为:2Na+2H2O=2NaOH+H2↑;(2)Na与H2O反应的产物是NaOH和H2,反应很快,并放出大量的热,氢气是可燃性气体,可能与氧气发生爆炸,因此Na的用量多容易发生爆炸;(3)由于ρ(煤油)<ρ(钠)<ρ(水),故钠块放入后将落在煤油和水的界面上,钠与水反应,有氢气生成,氢气推动钠块上浮,当氢气逸出后,钠块又下沉到煤油与水的界面上与H2O继续发生反应,重复发生上述现象,使Na与H2O的反应速率减慢。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,44.8L NO与22.4L O2反应后的分子数是2NA
B. 12.5mL 16mol·L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA
C. 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA
D. 0.5mol苯乙烯(![]() )中含有碳碳双键的数目为2NA
)中含有碳碳双键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室探究金属Mg在NOx中的燃烧产物。回答下列问题:
(1)推测金属Mg在NOx中的燃烧产物为MgO、N2和Mg3N2,则反应的化学方程式为__________________________________________________________。
(2)设计下列装置完成反应且验证产物中有N2(夹持装置已略去,部分装置可重复使用)。
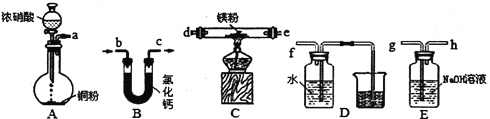
①选择上图中的装置,按气流方向将其连接,用接口字母表示的顺序为______________。安装仪器后,首先检查装置的气密性,然后进行的操作是__________________。
②装置A中仪器名称为_______________________________________,反应的化学方程式为_____________________________________________。
③验证产物中有N2生成的现象为_______________________________________________。
(3)检验Mg与NOx反应产物中是否存在Mg3N2的操作、现象和结论为________________________________________________________________________________________________
(4)Mg与NOx反应的产物MgO能溶于NH4Cl溶液且放出NH3,推测其可能的原因。
甲同学认为NH4Cl溶液存在水解平衡NH4++H2O![]() NH3·H2O+H+,因MgO+2H+=Mg2++H2O导致c(H+)减小,水解平衡右移导致NH3·H2O浓度增大,分解生成NH3。
NH3·H2O+H+,因MgO+2H+=Mg2++H2O导致c(H+)减小,水解平衡右移导致NH3·H2O浓度增大,分解生成NH3。
乙同学认为发生MgO+2NH4+=Mg2++H2O+2NH3↑而溶解。
请设计实验探究乙同学的推测是否合理________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示。电池反应为 2Li+nS=Li2Sn。Li+可在固体电解质中迁移。下列说法不正确的是( )

A. 放电时,锂在负极上发生氧化反应
B. 放电时,正极的电极反应式为nS+2e-+2Li+=Li2Sn
C. 充电时,锂电极为阴极,与电源负极相连
D. 充电时,理论上阳极失去2mol电子生成32g硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的说法不正确的是( )
A. 化石能源物质内部贮存着大量的能量
B. 植物的光合作用使太阳能转化为化学能
C. 由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
D. 燃料燃烧时只是将化学能转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是化学实验的常用方法之一。下表探究影响H2O2分解反应速率的因素是
温度 | 浓度 | 体积 | 催化剂 |
25℃ | 5%H2O2 | 5mL | FeCl3 |
25℃ | 5%H2O2 | 5mL | MnO2 |
A. 温度 B. 浓度 C. 体积 D. 催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二氮(N2O5)是有机合成中常用的绿色硝化剂,可用NO2与O3反应制得。某化学兴趣小组设计如下实验装置制备N2O5 (部分装置略去)。

(1)铜和浓硝酸反应的离子方程式为____________________________。
加入浓硝酸后,装置Ⅰ中烧瓶上部可观察到的现象是______________。
(2)仪器a的名称为______________,该仪器中盛装的试剂是______________(填标号)。
A.生石灰 B.浓硫酸 C.碱石灰 D.五氧化二磷
(3)已知下列物质的有关数据。
物质 | 熔点/℃ | 沸点/℃ |
N2O5 | 41 | 32 (升华) |
N2O4 | -11 | 24 |
装置Ⅱ中持续通入O3,为得到尽可能多的纯净的N2O5,温度控制在24℃32℃。
收集到的N2O5固体中含有液态物质,可能原因是_________________。
(4)装置Ⅲ的作用是____________________________________。
(5)化学兴趣小组用制得的N2O5制备少量对硝基甲苯(![]() ,相对分子质量137)。步骤如下:在三口烧瓶中放入催化剂和30 mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol·L-1), 30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g。回答下列问题:
,相对分子质量137)。步骤如下:在三口烧瓶中放入催化剂和30 mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol·L-1), 30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g。回答下列问题:
①制备对硝基甲苯的化学方程式为__________________________。
②N2O5生成对硝基甲苯的转化率为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com