
【题目】下列说法中,正确的是( )
A. KOH的摩尔质量是56g
B. 一个二氧化碳分子的质量就是其相对分子质量
C. 硫原子的摩尔质量就是硫的相对原子质量
D. 氦气的摩尔质量以克每摩尔为单位时在数值上等于它的相对原子质量
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似.
A. ①②③ B. ②③ C. ③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有20mL浓度为0.04mol·L-1的Na2SO3溶液恰好与10mL浓度为0.02mol·L-1的K2A2O7溶液完全反应。已知Na2SO3可被K2A2O7氧化为Na2SO4,则元素A在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
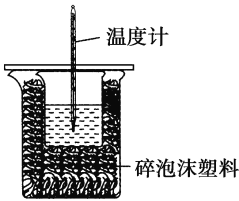
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )
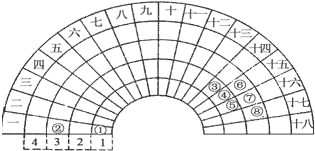
A. ③元素形成的单质晶体均属于原子晶体
B. ④元素的气态氢化物易液化,是因为其分子间存在氢键
C. ②、⑦、⑧对应的简单离子半径依次减小
D. ②⑤⑦三种元素形成的盐溶液在 25℃时的 pH值为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①![]() Li+中含有的中子数与电子数之比为 2:1
Li+中含有的中子数与电子数之比为 2:1
②在 C2H6分子中极性共价键与非极性共价键数之比为 3:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为 4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
A. ①② B. ②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:

已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、_____________________。
(2)操作Ⅰ的目的是_______________________和调节溶液的PH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是___________________________________________________________________。
(3)通过煅烧MnSO4·H2O可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余质量变化的曲线如图所示。根据图中数据可得MnxO4中x的值为______________。A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,写出该过程中发生反应的化学方程式:______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com