
【题目】下列叙述正确的是( )
①![]() Li+中含有的中子数与电子数之比为 2:1
Li+中含有的中子数与电子数之比为 2:1
②在 C2H6分子中极性共价键与非极性共价键数之比为 3:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为 4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
A. ①② B. ②③ C. ①③ D. ③④
科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
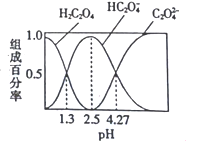
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对中学课本中可生成氢气的反应进行了研究,总结出两个可以生成H2的反应:①Zn+盐酸;②Na+水。为点燃经验纯后上述两个反应生成的H2,他们设计了图示装置。请回答下列问题:

(1)写出Na与H2O反应的化学方程式:__。
(2)实验小组在点燃用上述装置制得的H2时,实验①获得成功,实验②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是__。
(3)实验小组查阅资料知钠、煤油、水的密度分别为0.97 g·cm-3、0.8 g·cm-3、1.00 g·cm-3,并据此对实验进行改进,在改进后的实验中H2的生成速率减慢,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. KOH的摩尔质量是56g
B. 一个二氧化碳分子的质量就是其相对分子质量
C. 硫原子的摩尔质量就是硫的相对原子质量
D. 氦气的摩尔质量以克每摩尔为单位时在数值上等于它的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用电石和水反应制备的乙炔气体中含有少量的H2S气体,为了净化和检验乙炔气体,某学生设计如图所示装置,试回答下列问题

A B C
(1)写出A中发生反应的化学方程式__________________________
(2)饱和食盐水的作用是__________________
(3)B的作用是___________________________
(4)C中现象是__________________________,C中发生的反应类型是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学知识填空:
(1)NaHCO3溶液显碱性,用离子方程式表示其原因_______________,其溶液中离子浓度大小顺序为____________________。
(2)向50mL0.018molL﹣1的AgNO3溶液中加入50mL0.020molL﹣1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10﹣10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=____________。
②完全沉淀后,溶液的pH=____________________。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应式为2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2,该电池正极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了从KCl和MnO2的混合物中回收MnO2,下列操作顺序正确的是(已知MnO2为黑色难溶于水的固体)( )
A.溶解 过滤 蒸发 洗涤B.溶解 过滤 洗涤 干燥
C.溶解 过滤 蒸发 干燥D.溶解 洗涤 过滤 干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S的分解反应是一个可逆反应,其能量与反应进程的关系如图所示,下列有关说法正确的是( )

A. 正反应的活化能大于逆反应的活化能
B. 若减小体系的压强,则该反应的焓变将增大
C. 升高温度,化学反应速率加快,H2S的平衡转化率减小
D. 向密闭容器中充入1molH2S充分反应,吸收84.9kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com