
【题目】在含有大量Fe3+、H+、NO3-溶液中,还可以大量共存的离子是
A. OH- B. SCN- C. Cu2+ D. Fe2+
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
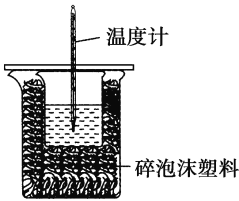
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )
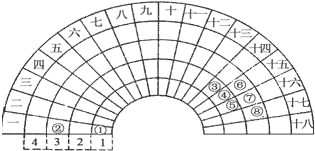
A. ③元素形成的单质晶体均属于原子晶体
B. ④元素的气态氢化物易液化,是因为其分子间存在氢键
C. ②、⑦、⑧对应的简单离子半径依次减小
D. ②⑤⑦三种元素形成的盐溶液在 25℃时的 pH值为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①![]() Li+中含有的中子数与电子数之比为 2:1
Li+中含有的中子数与电子数之比为 2:1
②在 C2H6分子中极性共价键与非极性共价键数之比为 3:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为 4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
A. ①② B. ②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Br位于元素周期表第_____周期第_____族;基态Na+核外有_____种运动状态不同的电子;Mg基态原子核外电子排布式为_____。
(2)用“>”或“<”填空:
第一电离能 | 粒子半径 | 熔点 | 键的极性 |
N_____S | S2—_____ Mg2+ | SO3______Na2O2 | H﹣O_____H﹣N |
(3)已知多硫化钠﹣溴储能电池是一种二次电池,结构如图。电池总反应为:2Na2S3+2NaBr![]() 3Na2S2+Br2。
3Na2S2+Br2。
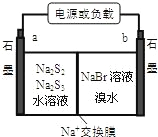
①放电时Na+向_____极迁移(填“a 或 b”);
②充电时阴极电极反应式为:______________。
(4)已知N4为正四面体结构,N﹣N键能为167kJ/mol,N≡N 键能为 942kJ/mol。写 出N4(g)转化为N2(g)的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:

已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、_____________________。
(2)操作Ⅰ的目的是_______________________和调节溶液的PH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是___________________________________________________________________。
(3)通过煅烧MnSO4·H2O可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余质量变化的曲线如图所示。根据图中数据可得MnxO4中x的值为______________。A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,写出该过程中发生反应的化学方程式:______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因创制新型抗疟药——青蒿素(结构如图)和双氢青蒿素的贡献,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,荣获2015年诺贝尔奖生物学或医学奖。下列有关青蒿素的叙述不正确的是

A. 分子式为C15H22O5
B. 它在乙醚中的溶解度大于在水中的溶解度
C. 能发生取代反应、水解反应、加成反应,不能发生氧化反应
D. 该物质不稳定,容易受到热和还原性物质的影响而发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类生产和生活中必不可少的重要金属(如图)。

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___。计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%…是指各同位素的____。
(2)铁原子中有___种能量不同的电子,铁原子次外层的电子云有____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为_________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于阴极,电解质溶液是____。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:___Fe(NO3)3+___NaOH+____Cl2→___Na2FeO4+ ___NaNO3+___NaCl+___H2O;高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是_______________。
(6)0.03mol的铁加到过量的 HNO3中,加热,铁完全溶解,若生成 NO、NO2的混和气体共1.12L(标准状况),将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积_____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com