
����Ŀ����1��Brλ��Ԫ�����ڱ���_____���ڵ�_____�壻��̬Na+������_____���˶�״̬��ͬ�ĵ��ӣ�Mg��̬ԭ�Ӻ�������Ų�ʽΪ_____��
��2���á�����������գ�
��һ������ | ���Ӱ뾶 | �۵� | ���ļ��� |
N_____S | S2��_____ Mg2+ | SO3______Na2O2 | H��O_____H��N |
��3����֪�����Ʃ��崢�ܵ����һ�ֶ��ε�أ��ṹ��ͼ������ܷ�ӦΪ��2Na2S3+2NaBr![]() 3Na2S2+Br2��
3Na2S2+Br2��
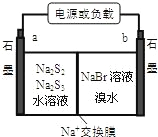
�ٷŵ�ʱNa+��_____��Ǩ�ƣ��a �� b������
�ڳ��ʱ�����缫��ӦʽΪ��______________��
��4����֪N4Ϊ��������ṹ��N��N����Ϊ167kJ/mol��N��N ����Ϊ 942kJ/mol��д ��N4��g��ת��ΪN2��g�����Ȼ�ѧ����ʽ________________��
���𰸡� �� ��A 10 1s22s22p63s2 �� �� �� �� b 2S32��+2e��=3S22�� N4��g��=2N2��g����H=��882kJ/mol
��������
(1)Br��ԭ������Ϊ35��ԭ�ӽṹ����4�����Ӳ�������������Ϊ7��Na��������Ϊ11����̬Na+������10��������Mg��̬ԭ�Ӻ���12��������
(2)�ǽ�����Խǿ����һ������Խ�������Ӳ�Խ�������Ӱ뾶Խ�������Ӿ�����۵���ڷ��Ӿ�����۵���O�ķǽ����Ա�N��ǿ������ļ���ǿ��
(3) ��ԭ��������������������ƶ����ڳ��ʱ�������Դ��������,�����õ����ӷ�����ԭ��Ӧ��
(4)����Ϣ����֪��N4��g��=2N2��g�� ��H=6��E��N��N����2��E��N��N�����Դ��������
��1��Br��ԭ������Ϊ35��ԭ�ӽṹ����4�����Ӳ㣬����������Ϊ 7����λ�ڵ������ڢ�A�壻Na��������Ϊ 11����̬ Na+������10�����ӣ�����10���˶�״̬��ͬ�ĵ��ӣ�Mg��̬ԭ�Ӻ��� 12�����ӣ����̬ԭ�Ӻ�������Ų�ʽΪ 1s22s22p63s2��
��ˣ������Ϊ���ģ���A��10��1s22s22p63s2��
��2���ǽ�����N��S����һ������ N��S�����Ӳ�Խ�࣬���Ӱ뾶Խ�������Ӱ뾶ΪS2����Mg2+�����Ӿ�����۵���ڷ��Ӿ�����۵㣬���۵�Ϊ SO3��Na2O2��O�ķǽ����Ա� N ��ǿ������ļ���ΪH��O>H��N��
��ˣ������Ϊ��>��>��<��>��
��3���ɵ�ط�Ӧ��֪���ŵ�ʱ��Br2�õ����ӣ�S22��ȥ���ӣ���aΪ������bΪ��������ԭ����У��������������ƶ����� Na+�� b�ƶ��ڳ��ʱ�������Դ���������������õ����ӷ�����ԭ��Ӧ�������缫��ӦʽΪ2S32��+2e��=3S22����
��ˣ������Ϊ��b��2S32��+2e��=3S22����
��4������Ϣ��֪ N4��g��=2N2��g�� ��H=6��E��N��N����2��E��N��N��=6��167kJ/mol��2��942kJ/mol=��882kJ/mol�����Ȼ�ѧ����ʽΪ N4��g��=2N2��g����H=��882kJ/mol��
��ˣ������Ϊ��N4��g��=2N2��g����H=��882kJ/mol��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������A�еķ�Ӧ��ʼ�����ֱ�������в�������ش��й����⣺
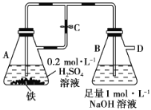
(1)��ֹˮ��C��B��������ʲô��������__________________________________________��
(2)����ʼʱֹˮ��C�رգ�����A�еķ�Ӧ���ڽ���ʱ��B��������ʲô��������_________________��д��B�������йط�Ӧ�Ļ�ѧ����ʽ��_____________________��
(3)���ȴ�ֹˮ��Cһ��ʱ�䣬����A�еķ�Ӧ���ڽ���ʱ���ٹر�ֹˮ��Cһ�����B��������ʲô��������_________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᡢ����Ͱ�ˮ����ѧ��ѧ�г���������������ijУʵ��С������Ũ���ᡢ�������Ũ��ˮ�ֱ�������Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ��100 mL���������ʵ�飬�ݴ˻ش��������⣺
��1������������������Һ��PH�ɴ�С��˳����____________________��
��2��25��ʱ������pH��ֽ���0.1 mol��L��1������Һ��pHԼΪ5������Թ��������ĵ��볣��ԼΪ__________________����10 mL����Һ�м��������������������ܽ��������Һ�¶Ⱥ������С�仯����Һ��![]() ��ֵ��_________(��������������С������ȷ����)��
��ֵ��_________(��������������С������ȷ����)��
��3����Ũ�Ⱦ�Ϊ0.1 mol��L��1������Ͱ�ˮ�����������������û����Һ��_______��(����������������������������)��ԭ����__________________(�����ӷ���ʽ��ʾ)��
�����û����Һ���������ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)��������������ȷ����
4NO(g)+6H2O(g)��������������ȷ����
A���ﵽ��ѧƽ��״̬ʱ��4v��(O2)= 5v��(NO)
B������λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽ��ѧƽ��״̬
C���ﵽ��ѧƽ��״̬�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D����ѧ��Ӧ���ʵĹ�ϵΪ2v��(NH3)= 3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��д���Fe3+��H+��NO3-��Һ�У������Դ��������������
A. OH- B. SCN�� C. Cu2+ D. Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������������Ҫ�������������ĺ�����������NaClO2��NaClO��ClO2 ��Cl2
�ش�����������
��1��NaClO2�����Ļ�ѧ��������________________��
��2��������Ͷ��ˮ����һ��ʱ����백��ϵõ�һ�ֽ�����Ȱ�(NH2Cl)��NH2Cl �����Ի�����������Ҳ��һ��ǿɱ���������������ڳ�������ˮ��������������________________���û�ѧ����ʽ��ʾ����
��3�� ����Ч�Ⱥ��������������������������������������䶨����ÿ�˺��������������������൱�ڶ��ٿ�Cl2 �������������������ֺ���������������������ǿ����________________��
��4������ˮ����ClO2 �������ˮ����Ҫ��ClO2 ��Ũ����0.1~0.8 mg��L-1֮�䡣�õ��������ClO2 �����������ˮ��ClO2 Ũ�ȵ�ʵ�鲽��������
������.ȡһ�������ˮ�������������⻯������������������Һ���������������������Һ��
������.��Na2S2O3 ��Һ�ζ������������õ���Һ��
��֪��a. ����ʱ����ͬpH �����������������±���ʾ��
pH | 2 | 7 |
�������� | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-��2I-��
���������з�Ӧ����ʱ��Һ��___________��������ɫ��������ɫ����
����ˮ�������Ϊ1.0L���ڲ�����������10mL1.0��10-3mol��L-1Na2S2O3 ��Һ�����ˮ����c(ClO2)=___________mg��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������ͼ����ᰬ˾���(F)��һ�ֺϳ�·�����£�


��֪��
�ش��������⣺
��1��A�Ļ�ѧ������____________��F�к��������ŵ�������___________________��
��2����B����C�ķ�Ӧ����Ϊ____________����D����E�ķ�Ӧ����Ϊ____________��
��3��B�Ľṹ��ʽΪ____________��
��4����C����D�Ļ�ѧ����ʽΪ____________��
��5����ȡ�������廯����X��E��ͬ���칹�壬1molX��������NaHCO3��Ӧ������44.8L����״����CO2����˴Ź���������ʾ��5�ֲ�ͬ��ѧ�������⣬��������֮��Ϊ9:2:2:2:1��д��2�ַ���Ҫ���X�Ľṹ��ʽ��________________________________________________��
��6��д���Ա��״��ͱ�����Ϊԭ���Ʊ� �ĺϳ�·��_____________���������Լ���ѡ����
�ĺϳ�·��_____________���������Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����Ӧ�õ�˵���У�����ȷ���ǣ� ��
A.Na2CO3�Ƿ��ͷ۵���Ҫ�ɷ�֮һB.MgO���������²���
C.�⻯���������˹�����D.��������������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ɫ��Ӧ����������ȷ����
A.ֻ�н����Ļ���������ʱ�Ż��в�ͬ����ɫ
B.ÿ��ʵ���˿��Ҫ��ˮϴ��
C.������ɫ�ܲ���ֻ������ɫ��˵����Ʒ�к�KԪ�ض�����NaԪ��
D.����Ʒ���ճʻ�ɫ���ж�һ����NaԪ�أ��������ų�����������Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com