
【题目】下列有关物质应用的说法中,不正确的是( )
A.Na2CO3是发酵粉的主要成分之一B.MgO常用作耐高温材料
C.碘化银可用于人工降雨D.氯气可用于自来水消毒
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内。在玻璃反应管内装入适量水(使钠块不与水接触)。实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起,使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
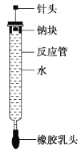
(1)钠与水反应的离子方程式为__________________________________________________。
(2)实验中“钠块熔化为闪亮的小球”说明_____________________;向烧杯中的溶液中滴加____________,溶液变红,说明钠与水反应生成碱性物质。
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为____________g(设当时实验条件下气体摩尔体积为V mL/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Br位于元素周期表第_____周期第_____族;基态Na+核外有_____种运动状态不同的电子;Mg基态原子核外电子排布式为_____。
(2)用“>”或“<”填空:
第一电离能 | 粒子半径 | 熔点 | 键的极性 |
N_____S | S2—_____ Mg2+ | SO3______Na2O2 | H﹣O_____H﹣N |
(3)已知多硫化钠﹣溴储能电池是一种二次电池,结构如图。电池总反应为:2Na2S3+2NaBr![]() 3Na2S2+Br2。
3Na2S2+Br2。
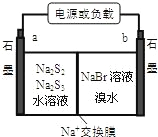
①放电时Na+向_____极迁移(填“a 或 b”);
②充电时阴极电极反应式为:______________。
(4)已知N4为正四面体结构,N﹣N键能为167kJ/mol,N≡N 键能为 942kJ/mol。写 出N4(g)转化为N2(g)的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活生产中常见的物质里含有的有机物属于高分子化合物的是
A. 植物中所含的非常复杂的叶绿素 B. 石油分馏所得的重油中含有的C16H34
C. 植物油水解得到的高级脂肪酸 D. 芹菜中含有的粗糙的纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因创制新型抗疟药——青蒿素(结构如图)和双氢青蒿素的贡献,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,荣获2015年诺贝尔奖生物学或医学奖。下列有关青蒿素的叙述不正确的是

A. 分子式为C15H22O5
B. 它在乙醚中的溶解度大于在水中的溶解度
C. 能发生取代反应、水解反应、加成反应,不能发生氧化反应
D. 该物质不稳定,容易受到热和还原性物质的影响而发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-
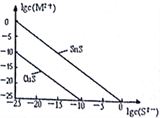
①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是一种重要的化工原料,主要成分是CuFeS2,另外还有少量的氧化铝、二氧化硅及水分,通过化学工艺可获得许多化工产品。
(1)铜元素位于元素周期表中_________(填写周期、族);基态Fe原子的价层电子轨道表达式为_____;
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是_________(必要化学用语及文字简答)。
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是__________。
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式______________(如有配位键,请 用“→”表 示 )。(5)黄铜矿在空气中高温灼烧可以得到固体混合物和废气,固体混合物中有X和Y两化合物。固体化合物X的晶胞模型如图甲所示:
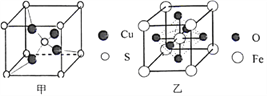
①化合物X的化学式:___________;
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为___________;SO3分子空间构型是___________。
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①固定好滴定管F并使滴定管尖嘴充满液体;
②用蒸馏水洗涤碱式滴定管F,并立即注入NaOH溶液至“0”刻度线以上;
③用标准液滴定至终点,记下滴定管液面读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤调节液面至“0”或“0”刻度线稍下,并记下读数。
请回答:
(1)以上步骤合理的顺序为(填编号)____________________,
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
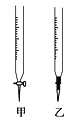

(3)滴定管F中应该选择右图中滴定管_____(填标号)。
(4)错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)
A.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗___________;
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确___________;
C.用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液___________;
D.配制标准溶液的NaOH中混有KOH杂质___________;
(5)滴定操作中,左手_____________,右手______________,眼睛应观察(填编号)_________A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)判断滴定终点的现象是:锥形瓶中溶液______________________________;
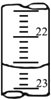
(7)如下图是某次滴定时的滴定管中的液面,其读数为________mL;
(8)根据下列数据:请计算待测盐酸溶液的浓度:______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明上次考试化学没考好,很沮丧。班主任杜老师开导他说:学习化学一是要有兴趣;二是要做好归纳总结、发现规律,同时还要对特殊情况适当记忆;三是要重视基础,抓住问题的本质。听了老师的话,小明总结了刚学习过的内容,你认为正确的是( )
①由非金属元素组成的化合物一定是共价化合物
②离子化合物一定含离子键,也可能含共价键
③共价键既可能存在于单质和共价化合物中,也可能存在于离子化合物中
④金属性越强的元素相应的简单阳离子氧化性一般越弱
⑤含金属元素的化合物不一定是离子化合物
⑥任何元素的原子都是由核外电子和核内中子、质子组成的
⑦化学反应一定伴随着能量的变化
⑧质子数相同的微粒一定属于同种元素
A. ②③④⑤⑦ B. ②③⑤⑦⑧ C. ①③④⑥⑦ D. ①②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com