
����Ŀ��������������������������Ҫ�������������ĺ�����������NaClO2��NaClO��ClO2 ��Cl2
�ش�����������
��1��NaClO2�����Ļ�ѧ��������________________��
��2��������Ͷ��ˮ����һ��ʱ����백��ϵõ�һ�ֽ�����Ȱ�(NH2Cl)��NH2Cl �����Ի�����������Ҳ��һ��ǿɱ���������������ڳ�������ˮ��������������________________���û�ѧ����ʽ��ʾ����
��3�� ����Ч�Ⱥ��������������������������������������䶨����ÿ�˺��������������������൱�ڶ��ٿ�Cl2 �������������������ֺ���������������������ǿ����________________��
��4������ˮ����ClO2 �������ˮ����Ҫ��ClO2 ��Ũ����0.1~0.8 mg��L-1֮�䡣�õ��������ClO2 �����������ˮ��ClO2 Ũ�ȵ�ʵ�鲽��������
������.ȡһ�������ˮ�������������⻯������������������Һ���������������������Һ��
������.��Na2S2O3 ��Һ�ζ������������õ���Һ��
��֪��a. ����ʱ����ͬpH �����������������±���ʾ��
pH | 2 | 7 |
�������� | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-��2I-��
���������з�Ӧ����ʱ��Һ��___________��������ɫ��������ɫ����
����ˮ�������Ϊ1.0L���ڲ�����������10mL1.0��10-3mol��L-1Na2S2O3 ��Һ�����ˮ����c(ClO2)=___________mg��L-1
���𰸡� ���Ӽ������ۼ�(���Լ�) NH2Cl+H2O![]() NH3+ HClO(��NH2Cl+ 2H2O
NH3+ HClO(��NH2Cl+ 2H2O![]() NH3��H2O+ HClO) ClO2 ��ɫ 0.675
NH3��H2O+ HClO) ClO2 ��ɫ 0.675
����������1��NaClO2�������������ӻ���������Ӻ�ClO2-֮��ͨ�����Ӽ���ϣ�ClO2-����ԭ�Ӻ���ԭ��ͨ�����ۼ�(���Լ�)��ϣ���NaClO2�����Ļ�ѧ�������У����Ӽ������ۼ�(���Լ�)��
��2�������Ի�����������������NH2Clˮ�⣬���ɾ���ǿ�����Ե�HClO��ɱ���������û�ѧ����ʽ��ʾΪ��NH2Cl+H2O![]() NH3+HClO(��NH2Cl+2H2O
NH3+HClO(��NH2Cl+2H2O![]() NH3H2O+HClO)��
NH3H2O+HClO)��
��3��NaClO2��NaClO��ClO2��Cl2���������Ա���ԭΪCl-�����1mol�����������ʣ��õ����ӷֱ�Ϊ��4mol��2mol��5mol��2mol�����Ը�1molNaClO2��NaClO��ClO2�����������ֱ��൱��2mol��1mol��2.5molCl2���������������ݡ���Ч�Ⱥ������Ķ��壬�������ֺ�������������������֮��Ϊ�� ![]() ��
�� ![]() ��
�� ![]() ��1����������������ǿ����ClO2��
��1����������������ǿ����ClO2��
��4��������֪�����������I2�������Na2S2O3��Һ��I2��Ӧ����I-������Ϊ���������ָʾ�������Բ�����з�Ӧ����ʱ��Һ����ɫ���ڲ����ClO2��⻯����Һ��Ӧ��������������Һ����pH�����ԣ��ɱ������ݿɵã�ClO2����ԭΪClO2-����Ӧ���ӷ���ʽΪ��2ClO2+2I-=2ClO2-+I2�������Ӧ���ӷ���ʽΪ��2S2O32-+I2=S4O62-��2I-�����Կɵù�ϵ��ClO2~S2O32-������c(ClO2)=10mL��10-3LmL-1��1.0��10-3mol��L-1��67.5gmol-1��1000mgg-1��1.0L=0.675mgL-1��


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��Ĺ��ɽ��������ҵ��� ��
A.����ũҩԪ��
B.�ƴ���Ԫ��
C.�ư뵼��Ԫ��
D.�ǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C����ѧ��ѧ�г������������ʣ�����֮����ת����ϵ����ͼ��ʾ(���ַ�Ӧ������������ȥ)��
![]()
(1)��A��һ�ֽ�����C�ǵ���ɫ���壬��B�Ļ�ѧʽΪ______��A��C��Ӧ�Ļ�ѧ����ʽΪ_________��
(2)��A��һ�ַǽ������䳣������Ϊ��ɫ���壬C������Ҫ���������壬��C�ķ���ʽΪ_______��B��C��Ӧ�Ļ�ѧ����ʽΪ___��
A��C�Ƿ���Է�����Ӧ______(��ܡ����ܡ�)�����ܣ���Ӧ�Ļ�ѧ����ʽΪ____________(�����ܣ��˿ղ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������̼ת��Ϊȼ����Ŀǰ���о��ȵ㣬2017�꡶��ѧ����־������һ�ֽ�CO2ת��Ϊ���ʹ���װ����ͼ��ʾ������˵����ȷ����

A. ͼ������ת���ķ�ʽֻ��1��
B. װ�ù���ʱ��H+��X�����ƶ���Y����Χ��Һ��pH����
C. X���ϵõ�CH3OH�ĵ缫��ӦʽΪ2CO2+4H2O+12e-==2CH3OH+3O2
D. ��X������1molC2H4��lmolCH3OH����·������18mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Brλ��Ԫ�����ڱ���_____���ڵ�_____�壻��̬Na+������_____���˶�״̬��ͬ�ĵ��ӣ�Mg��̬ԭ�Ӻ�������Ų�ʽΪ_____��
��2���á�����������գ�
��һ������ | ���Ӱ뾶 | �۵� | ���ļ��� |
N_____S | S2��_____ Mg2+ | SO3______Na2O2 | H��O_____H��N |
��3����֪�����Ʃ��崢�ܵ����һ�ֶ��ε�أ��ṹ��ͼ������ܷ�ӦΪ��2Na2S3+2NaBr![]() 3Na2S2+Br2��
3Na2S2+Br2��
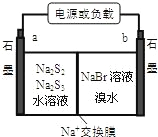
�ٷŵ�ʱNa+��_____��Ǩ�ƣ��a �� b������
�ڳ��ʱ�����缫��ӦʽΪ��______________��
��4����֪N4Ϊ��������ṹ��N��N����Ϊ167kJ/mol��N��N ����Ϊ 942kJ/mol��д ��N4��g��ת��ΪN2��g�����Ȼ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������AG��ʾ��Һ����ȣ�AG�Ķ���ΪAG=lg![]() �����б�����ȷ���ǣ�������
�����б�����ȷ���ǣ�������
A. ��25��ʱ����Һ��pH��AG�Ļ��㹫ʽΪAG=14+pH
B. ��25��ʱ������Һ�����ԣ���pH��7��AG��0
C. ��25��ʱ������Һ�ʼ��ԣ���pH��7��AG��0
D. ��25��ʱ������Һ�����ԣ���pH=7��AG=1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������г����������ﺬ�е��л������ڸ߷��ӻ��������
A. ֲ���������ķdz����ӵ�Ҷ���� B. ʯ�ͷ������õ������к��е�C16H34
C. ֲ����ˮ��õ��ĸ�֬���� D. �۲��к��еĴֲڵ���ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��COS ��H2S ������ú������Ʒ��ԭ��������֪��
��.COS(g)+H2(g)![]() H2S(g)+CO(g) ��H=X kJ��mol-1��
H2S(g)+CO(g) ��H=X kJ��mol-1��
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=-42 kJ��mol-1��
CO2(g)+H2(g) ��H=-42 kJ��mol-1��
��1������1mol�����еĻ�ѧ���������յ��������±���ʾ��
���� | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
����/kJ��mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
��X=_____________________��
��2����10 L�ݻ�������ܱ������г���1mol COS(g)��1mol H2(g)��1mol H2O(g)����������������Ӧ����ij�¶��´ﵽƽ�⣬��ʱCO���������Ϊ4%���Ҳ�ô�ʱCOS�����ʵ���Ϊ0.80mol������¶��·�ӦI��ƽ�ⳣ��Ϊ_________________��������λ��Ч���֣�
��3������������ͬ��2 L���ݾ��ȣ������û�������������ܱ�����M��N����M �г���1mol CO��1molH2O����N �г���1molCO2��1molH2������700���¿�ʼ������з�Ӧ���ﵽƽ��ʱ������˵����ȷ����_________��
A.��������CO �����ʵ���M>N
B.������������Ӧ����M
C.����M ��CO��ת����������N ��CO2��ת����֮��С��1
D.�������з�Ӧ��ƽ�ⳣ��M>N
��4�������ᡢ̼���Ϊ��Ԫ���ᣬ�䳣���µĵ��볣�����±���
H2CO3 | H2S | |
Ka1 | 4.4�� 10-7 | 1.3��10-7 |
Ka2 | 4.7�� 10-11 | 7.1��10-15 |
ú�����������в�����H2S ����������Na2CO3��Һ���գ��÷�Ӧ�����ӷ���ʽΪ______________�������£���100mL0.2mol��L-1InaOH��Һ����448mL�������H2S���壬��Ӧ����Һ������Ũ�ȴӴ�С��˳��Ϊ__________________________________��
��5��25��ʱ����Na2S����Cu2+��Sn2+���ֽ������� (M2+)������S2-���Ũ�ȵĶ���ֵ1gc(S2-
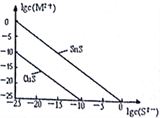
��25��ʱKsp(CuS)=_______________��
��25��ʱ��50mL��Sn2+��Cu2+Ũ�Ⱦ�Ϊ0.01mol/L�Ļ����Һ����μ���Na2S��Һ����Na2S��Һ�ӵ�150mLʱ��ʼ����SnS���������ʱ��Һ��Cu2+Ũ��Ϊ_____________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���о�Ԫ�����ʵݱ����ʵ��ʱ���Լ������һ��ʵ�鷽��������¼���й�ʵ������(���±������еġ�ʵ�鷽�����롰ʵ������ǰ��һ���Ƕ�Ӧ��ϵ)��
ʵ�鲽�� | ʵ������ |
�ٽ�þ����ɰֽ��ĥ�����Թ��У���������ˮ������ˮ���ڣ�������Һ�еμӷ�̪��Һ | A.����ˮ���ϣ��۳�С���Ĵ��ζ���������˻˻��������֮��ʧ����Һ��ɺ�ɫ |
�������Ƶ�Na2S��Һ�еμ����Ƶ���ˮ | B.�������������Һ���dz��ɫ |
�۽�һС������Ʒ�����з�̪��Һ����ˮ�� | C.���ҷ�Ӧ��Ѹ�ٲ���������ɫ���� |
�ܽ�þ��Ͷ��ϡ������ | D.��Ӧ��ʮ�־��ң�������ɫ���� |
�ݽ�����Ͷ��ϡ������ | E.���ɰ�ɫ��״�������̶�������ʧ |
����AlCl3��Һ�еμ�NaOH��Һ������ | F.���ɵ���ɫ���� |
���������ͬѧ���������ʵ�鱨�档
(1)ʵ��Ŀ�ģ��о�__________________Ԫ�����ʵݱ���ɡ�
(2)ʵ����Ʒ���Լ��������ơ�þ����������ϡ���ᡢ������ˮ������Na2S��Һ��AlCl3��Һ��NaOH��Һ����̪��Һ�ȡ�
������______��______����ֽ���ԹܼС���ͷ�ιܡ����ӡ�С��������Ƭ��ɰֽ�����ȡ�
(3)ʵ�����ݣ�(��д��ʵ�鲽���Ӧ��ʵ������ı�ź͢٢ڵĻ�ѧ����ʽ����ʵ��Ľ���)
ʵ������ | �� | �� | �� | �� | �� | �� |
ʵ������(��A��F) | __ | __ | __ | __ | __ | __ |
��__________________________________________________��
��___________________________________________________��
��ʵ��Ľ��ۣ�__________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com