
【题目】有人曾建议用AG表示溶液的酸度,AG的定义为AG=lg![]() 。下列表述正确的是( )
。下列表述正确的是( )
A. 在25℃时,溶液的pH与AG的换算公式为AG=14+pH
B. 在25℃时,若溶液呈酸性,则pH<7,AG<0
C. 在25℃时,若溶液呈碱性,则pH>7,AG<0
D. 在25℃时,若溶液呈中性,则pH=7,AG=1
【答案】C
【解析】从pH与AG的定义式中寻找c(H+)与c(OH-)的相对大小与溶液的酸碱性的关系。A、在25℃时,溶液的pH与AG的换算公式为AG=lg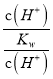 =lg
=lg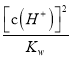 =14+2lg
=14+2lg![]() =2×(7-pH),选项A错误; B、在25℃时,酸性溶液中c(H+)> c(OH-),即c(H+)>10-7mol/L,则pH<7;又
=2×(7-pH),选项A错误; B、在25℃时,酸性溶液中c(H+)> c(OH-),即c(H+)>10-7mol/L,则pH<7;又 >1,则AG>0,选项B错误;C、在25℃时,碱性溶液中c(H+)< c(OH-),即c(OH-)>10-7mol/L,则pH>7;又
>1,则AG>0,选项B错误;C、在25℃时,碱性溶液中c(H+)< c(OH-),即c(OH-)>10-7mol/L,则pH>7;又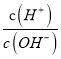 <1,则AG<0,选项C正确;D、在25℃时,中性溶液中c(H+)= c(OH-),则pH=7,因
<1,则AG<0,选项C正确;D、在25℃时,中性溶液中c(H+)= c(OH-),则pH=7,因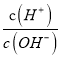 =1,AG=lg1=0,选项D错误。答案选择C。
=1,AG=lg1=0,选项D错误。答案选择C。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO![]() )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
B. 25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH
C. 常温下将10mlpH=4的醋酸溶液稀释至100ml,所得溶液4<pH<5
D. 向NaAlO2溶液中滴加NaHCO3溶液相互促进水解,有沉淀和气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.1 mol·L-1CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、量筒、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算,应选择下列________。
A.需要CuSO4固体8 g B.需要CuSO4固体7.7 g
C.需要CuSO4·5H2O晶体12.5 g D.需要CuSO4·5H2O晶体12.0 g
(3)称量。所用砝码生锈则所配溶液的浓度会_____(填“偏高”“偏低”或“无影响”。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是____________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Cu、H、O、S、Mg是常见的六种元素。
(1)Mg位于元素周期表第______周期第______族;N与O的基态原子核外未成对电子个数比为_______;Cu的基态原子电子排布式为______。
(2)用“>”或“<”填空:
碱性:Mg(OH)2______Cu(OH)2 第一电离能:O______N
熔点:MgS______MgO 稳定性:H2S______H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为______。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消毒剂在生产、生活中有重要的作用,常见的含氯消毒剂有NaClO2、NaClO、ClO2 和Cl2
回答下列问题:
(1)NaClO2所含的化学键类型有________________。
(2)消毒剂投入水中,一段时间后与氨结合得到一种结合性氯胺(NH2Cl)。NH2Cl 在中性或酸性条件下也是一种强杀菌消毒剂,常用于城市自来水消毒。其理由是________________(用化学方程式表示)。
(3) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。上述四种含氯消毒剂中消毒能力最强的是________________。
(4)自来水厂用ClO2 处理后的水中,要求ClO2 的浓度在0.1~0.8 mg·L-1之间。用碘量法检测ClO2 处理后的自来水中ClO2 浓度的实验步骤如下:
步骤Ⅰ.取一定体积的水样,加入足量碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。
步骤Ⅱ.用Na2S2O3 溶液滴定步骤Ⅰ中所得的溶液。
已知:a. 操作时,不同pH 环境中粒子种类如下表所示。
pH | 2 | 7 |
粒子种类 | Cl- | ClO2- |
b. 2S2O32-+I2==S4O62-+2I-。
①步骤Ⅱ中反应结束时溶液呈___________(填“蓝色”或“无色”)
②若水样的体积为1.0L,在步骤Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,则该水样中c(ClO2)=___________mg·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、C、N、O、Si、S 是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在

(1)Si位于元素周期表第______周期______族;基态硼原子的电子排布式为______;C、N、Si元素原子的第一电离能由大到小的顺序为______。
(2)BF3与一定量的水可形成如图1晶体R,晶体R中各种微粒间的作用力包含______(填字母)。
a.离子键 b.共价键 c.范德华力 d.金属键
(3)乙二胺(H2N﹣CH2﹣CH2﹣NH2)与CuCl2溶液可形成配离子(结构如图2)。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是______。
(4)在25℃、101kpa,NO2(g)与SO2(g)反应生成 SO3(g)和 NO(g),已知每生成1gSO3(g)放出热量 0.52kJ,该反应的热化学方程式是______。
(5)硼砂(Na2B4O710H2O)可用作清洁剂或杀虫剂,易溶于水.在酸性溶液中会生成H3BO3,该反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 电解池将化学能转化为电能
B. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
C. 用惰性电极电解饱和NaCl溶液一段时间后,若 通入氯化氢气体,能使电解液恢复到原状态
D. 用惰性电极电解Na2SO4溶液,阴阳两极气体产物的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com