
【题目】N、Cu、H、O、S、Mg是常见的六种元素。
(1)Mg位于元素周期表第______周期第______族;N与O的基态原子核外未成对电子个数比为_______;Cu的基态原子电子排布式为______。
(2)用“>”或“<”填空:
碱性:Mg(OH)2______Cu(OH)2 第一电离能:O______N
熔点:MgS______MgO 稳定性:H2S______H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为______。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目______。
【答案】三 IIA 3:2 1s22s22p63s23p63d104s1 > < < < Mg3N2(s)+4H2SO4(aq)=3MgSO4(aq)+(NH4)2SO4(aq)△H=﹣4aKJ/mol 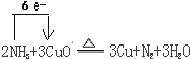
【解析】
试题 (1) 镁元素位于第三周期的IIA族。氮原子基态原子核外有3个未成对电子,氧原子有2个未成对电子,所以比例为3:2。铜为29号元素,电子排布为 [Ar]3d104s1或1s22s22p63s23p63d104s1。
(2)氢氧化镁的碱性强于氢氧化铜,氧元素和氮元素位于同一周期,从左到右,第一电离能增大。离子化合物的熔点看形成离子键的离子半径大小,硫离子半径大于阳离子,所以硫化镁的熔点小于氧化镁的熔点。非金属性越强,其气态氢化物稳定性越强,所以硫化氢的稳定性小于水。(3)氮化镁和硫酸反应生成硫酸镁和硫酸铵,所以每消耗1摩尔硫酸放热aKJ,所以消耗4摩尔硫酸,反应放热4aKJ,热化学方程式为:Mg3N2 (S) + 4 H2SO4 (aq) = 3MgSO4(aq)+ (NH4)2SO4 (aq) ΔH=-4akJ/mol。
(4)氨气和氧化铜反应生成铜和两种无污染的气体,所以生成氮气和水蒸气,方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】在科学史上每一次重大的发现都极大地推进了科学的发展。下列对化学史的描述正确的是
A. 侯德榜制的碱是NaOH B. 阿伏加德罗提出分子的概念
C. 道尔顿发现电子 D. 凯库勒的贡献在于制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。反应的化学方程式是___________________________________;样品中铝的质量为________g。
(2)另取a g样品将其点燃,恰好完全反应,该反应的化学方程式是2Al+Fe2O3![]() 2Fe+Al2O3,氧化铁与铝的质量比是________。
2Fe+Al2O3,氧化铁与铝的质量比是________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.工业上生产水泥和玻璃都要用石灰石做原料
B.玻璃钢是一种合金材料
C.除去氨气中的水蒸气可用无水氯化钙可做干燥剂
D.溶于水可以导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化碳转化为燃料是目前的研究热点,2017年《科学》杂志报道的一种将CO2转化为烃和醇的装置如图所示。下列说法正确的是

A. 图中能量转化的方式只有1种
B. 装置工作时,H+向X极区移动,Y极周围溶液的pH增大
C. X极上得到CH3OH的电极反应式为2CO2+4H2O+12e-==2CH3OH+3O2
D. 若X极生成1molC2H4和lmolCH3OH,电路中流过18mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)与镁是同主族元素.锶的单质及其化合物用途广泛,例如金属锶用于制造合金、光电管、照明灯,Sr(OH)2用于磨拉石的提纯,Sr(NO3)2用于烟火装置,SrCl2用于修补牙齿等。
(1)锶(Sr)位于周期表的第___周期___族,过氧化锶(SrO2)中锶元素的化合价为______。
(2)金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式______。
(3)金属锶很活泼,在空气中易被氧化,可保存在______中(填序号)。
①水 ②酒精 ③煤油
(4)锶的性质与钙类似。已知:CaCl2 易溶于水,CaF2难溶于水,请写出硝酸锶和氟化钠反应的离子方程式______。
(5)隔绝空气高温焙烧SrSO4和C粉的混合物,若2molSrSO4完全反应,只有S被还原并转移16mol电子,同时只生成一种可燃性气体,该反应的化学方程式:______。
(6)在t℃时,某Sr(OH)2的稀溶液中c(H+)=10—amolL—1,c(OH—)=10—bmolL—1,已知a+b=12.向该溶液中逐滴加入 pH=X 的盐酸,测得混合溶液的部分pH如表所示。
Sr(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的 pH | |
① | |||
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
若忽略溶液混合前后的体积变化,则X为______(用数字填空)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人曾建议用AG表示溶液的酸度,AG的定义为AG=lg![]() 。下列表述正确的是( )
。下列表述正确的是( )
A. 在25℃时,溶液的pH与AG的换算公式为AG=14+pH
B. 在25℃时,若溶液呈酸性,则pH<7,AG<0
C. 在25℃时,若溶液呈碱性,则pH>7,AG<0
D. 在25℃时,若溶液呈中性,则pH=7,AG=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关微粒的相互关系和特征描述正确的是( )
选项 | 微粒 | 相互关系 | 特征描述 |
A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
B | 新烷、2,2﹣二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
C |
| 同素异形体 | 铂作氨催化氧化时的催化剂 |
D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:碘的熔点为113℃,但固态的碘可以不经过熔化直接升华。下列说法错误的是
A. 操作①和③中的有机相从分液漏斗下端放出
B. 操作②中发生反应的离子方程式为2IO3- +5SO32-+2H+=I2+5SO42-十H2O
C. 操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、接引管及锥形瓶
D. 操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com