
【题目】锶(Sr)与镁是同主族元素.锶的单质及其化合物用途广泛,例如金属锶用于制造合金、光电管、照明灯,Sr(OH)2用于磨拉石的提纯,Sr(NO3)2用于烟火装置,SrCl2用于修补牙齿等。
(1)锶(Sr)位于周期表的第___周期___族,过氧化锶(SrO2)中锶元素的化合价为______。
(2)金属锶在常温下和水反应,有气体生成,写出该反应的化学方程式______。
(3)金属锶很活泼,在空气中易被氧化,可保存在______中(填序号)。
①水 ②酒精 ③煤油
(4)锶的性质与钙类似。已知:CaCl2 易溶于水,CaF2难溶于水,请写出硝酸锶和氟化钠反应的离子方程式______。
(5)隔绝空气高温焙烧SrSO4和C粉的混合物,若2molSrSO4完全反应,只有S被还原并转移16mol电子,同时只生成一种可燃性气体,该反应的化学方程式:______。
(6)在t℃时,某Sr(OH)2的稀溶液中c(H+)=10—amolL—1,c(OH—)=10—bmolL—1,已知a+b=12.向该溶液中逐滴加入 pH=X 的盐酸,测得混合溶液的部分pH如表所示。
Sr(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的 pH | |
① | |||
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
若忽略溶液混合前后的体积变化,则X为______(用数字填空)。
【答案】 五 ⅡA +2 Sr+2H2O=Sr(OH)2+H2↑ ③ Sr2++2F—=SrF2↓ SrSO4+4C![]() SrS+4CO↑ 4
SrS+4CO↑ 4
【解析】
(1)锶(Sr)是38号元素,五个电子层,最外层2个电子,所以锶位于周期表的第五周期,第ⅡA族,过氧化锶(SrO2)中氧是负一价,所以锶元素的化合价为+2价;
(2)金属锶在常温下和水反应,是活泼的锶与水中的氢离子发生氧化还原反应,产生氢气;
(3)金属锶很活泼,易与水中的氢发生置换反应和醇羟基中氢发生置换反应,由此分析解答;
(4)锶的性质与钙类似.已知:CaCl2易溶于水,CaF2难溶于水,符合复分解反应的条件,硝酸锶和氟化钠反应的离子方程式为:Sr2++2F-=SrF2↓;
(5)由SrSO4中只有S被还原,且1mol SrSO4反应电子转移8mol,则该反应的化学方程式为SrSO4+4C![]() SrS+4CO↑;
SrS+4CO↑;
(6)在t℃时,某Sr(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,则kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b),a+b=12,则Kw=1×10-12,中性溶液pH=6,说明温度高于常温下,据此分析解答。
(1)锶(Sr)是38号元素,五个电子层,最外层2个电子,所以锶位于周期表的第五周期,第ⅡA 族,过氧化锶(SrO2)中氧是负一价,所以锶元素的化合价为+2价。
因此,本题答案为:五 ;ⅡA;+2;
(2)金属锶在常温下和水反应,是活泼的锶与水中的氢离子发生氧化还原反应,产生氢气,反应的化学方程式Sr+2H2O=Sr(OH)2+H2↑。
因此,本题答案为:Sr+2H2O=Sr(OH)2+H2↑;
(3)金属锶很活泼,易与水中的氢发生置换反应和醇羟基中氢发生置换反应,所以可保存在煤油中。
因此,本题答案为:③;
(4)CaCl2易溶于水,CaF2难溶于水,硝酸锶和氟化钠反应的符合复分解反应的条件,离子方程式为:Sr2++2F—=SrF2↓。
因此,本题答案为:Sr2++2F—=SrF2↓;
(5)由SrSO4中只有 S被还原,且 1molSrSO4反应电子转移 8mol,则该反应的化学方程式为SrSO4+4C![]() SrS+4CO↑。
SrS+4CO↑。
因此,本题答案为:SrSO4+4C![]() SrS+4CO↑;
SrS+4CO↑;
(6)由②Sr(OH)2溶液的 pH=7,说明碱过量,c(OH—)×22.00mL﹣c(H+)×18.00mL=10—12+7×(22.00+18.00)mL,由③当恰好完全中和时,溶液的pH=6,即加盐酸的体积为 22.00mL时,恰好完全中和,根据 c(H+)×22.00mL=c(OH—)×22.00 mL,解之得盐酸c(H+)=10﹣4mol/L,pH=4,即X=4。
因此,本题答案为:4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
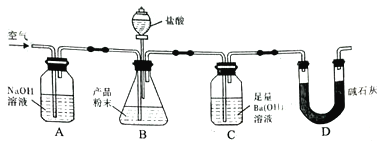
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科学家预测,月球的土壤中吸附着数百万吨的3He,每百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法中正确的是( )
A.4He原子核内含有4个质子
B.3He和4He互为同位素
C.3He原子核内含有3个中子
D.4He的最外层电子数为2,故4He活泼性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X,Y,Z,W四种元素,它们的原子序数分别为6、10、11、17,下列判断错误的是( )
A.X,W能形成共价化合物
B.Z,W能形成离子化合物
C.Y分子中存在共价键
D.Y和Z不能形成化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Cu、H、O、S、Mg是常见的六种元素。
(1)Mg位于元素周期表第______周期第______族;N与O的基态原子核外未成对电子个数比为_______;Cu的基态原子电子排布式为______。
(2)用“>”或“<”填空:
碱性:Mg(OH)2______Cu(OH)2 第一电离能:O______N
熔点:MgS______MgO 稳定性:H2S______H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为______。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
B.大理石与稀硝酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.硫酸溶液与氧氧化钡溶液混合:H++SO42-+Ba2++OH-=H2O+BaSO4↓
D.MgC12溶液与过量氨水反应:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
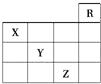
①X元素的原子有二个电子层,处于周期表的第15个纵行;②Z的原子序数为31,单质常温下为液体;③气态氢化物水溶液的酸性 X<Y<Z;④X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐;⑤Z的原子序数比Y大19,Y的原子序数比X大 9。
A. 只有② B. 只有①③④⑤ C. 只有①②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素。
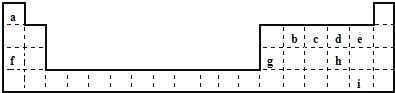
请回答下列问题:
(1)b、c、d三种元素的原子半径最大的是_________ (填元素符号);f、g对应的离子中离子半径较大的是_________(填离子符号)。
(2)i元素在周期表中的位置为_________;在元素 b、c、d、e、h、i的氢化物中,热稳定性最强的是________(填氢化物的化学式)。
(3)d、f、h三种元素形成的具有较强还原性的化合物A,与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯气体,该反应的离子方程式为_________ ;生成 标准状况下56L二氧化氯时,转移电子的数目为_________个。
(4)f、g元素的单质共5.0g在100mL水中完全反应,生成的溶液中只含有一种溶质,分步写出发生反应的离子方程式:①________;②________。所得溶液中溶质物质的量浓度为__________(液体的体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com