
����Ŀ����ͼ��Ԫ�����ڱ�ǰ�����ڵ�һ���֣����ж����Ԫ�ص�������ȷ���ǣ� ��
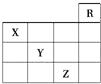
��XԪ�ص�ԭ���ж������Ӳ㣬�������ڱ��ĵ�15�����У���Z��ԭ������Ϊ31�����ʳ�����ΪҺ�壻����̬�⻯��ˮ��Һ������ X��Y��Z����X����̬�⻯����Y������������ˮ�����ܷ�Ӧ�����Σ���Z��ԭ��������Y��19��Y��ԭ��������X�� 9��
A. ֻ�Т� B. ֻ�Т٢ۢܢ� C. ֻ�Т٢ڢۢ� D. ȫ��
���𰸡�B
��������
����Ԫ�������ڱ��е�λ�ÿ�֪��RΪHe��XΪN��YΪS��ZΪBr�������ڱ���18�����У�����֪��ǰ�����ڣ�RԪ����Ȼ��He���ڵ�18�У���XԪ���ڵڶ����ڣ����ж������Ӳ㣬�������ڱ��ĵ�15�����У��ʢ���ȷ���ڸ�����Ԫ�����ֱ�Ϊ2��8��8��18���� Z �ұߵ�ϡ������ԭ������Ϊ36����Z��ԭ������Ϊ 35�ţ�ZΪ�壬������ΪҺ�壬�ʢڴ�����XΪ����YΪ��ZΪ�壬HBrΪǿ�ᣬH2SΪ���ᣬNH3��ˮ��ҺΪ���ԣ������� NH3��H2S��HBr���ʢ���ȷ����NH3��H2SO4��Ӧ����(NH4)2SO4���ʢ���ȷ���ݸ���ͬ��������Ԫ��ԭ������֮���֪��2��3�����ڼ�Ϊ8��3��4�����ڼ�ӵ� 13�п�ʼ���Ϊ 18�����Z��ԭ��������Y��19��Y��ԭ��������X�� 9���ʢ���ȷ����ȷ���Т٢ۢܢ�����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�X����Ҫ���ʣ�Y���������ʣ�Z��Ϊ��ȥ������Ҫ������Լ������������Լ���ȷ������� (����)
A | B | C | D | |
X | FeCl2��Һ | FeCl3��Һ | Fe | Na2SO4��Һ |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH��Һ | BaCl2��Һ |
A. A B. B C. C D. D
���𰸡�C
��������A��ͭ�����Ȼ�����Ӧ�����Ȼ��������Ȼ�ͭ�������������ʣ���A����B�����߾���Fe��Ӧ�������ϳ��ӵ�ԭ���ܳ��ӣ���B����C��Al��NaOH��Һ��Ӧ����Fe���ܣ����NaOH�ܽ����˿ɳ��ӣ���C��ȷ��D�����߾���BaCl2��Һ��Ӧ��Ӧ������������ӣ���D����ѡC��
�����͡���ѡ��
��������
19
����Ŀ��ij��ѧ��ȤС��������ͼװ�ý��С�����ˮ��Ӧ����ʵ�飬�������������ʣ���ش��������⣺
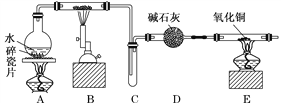
��1��Aװ�õ�������________________��B�з�Ӧ�Ļ�ѧ����ʽΪ_____________��
��2��D��������____________________________________________________________��
��3��E�������__________________________________________________________��
��4��A��B����װ����Ӧ�ȵ�ȼ_______���ľƾ��ƣ���ȼE���ƾ���֮ǰӦ���еIJ�����_______________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȣ�Sr����þ��ͬ����Ԫ�أ��ȵĵ��ʼ��仯������;�㷺�������������������Ͻ𡢹��ܡ������ƣ�Sr��OH��2����ĥ��ʯ���ᴿ��Sr��NO3��2�����̻�װ�ã�SrCl2���������ݵȡ�
��1���ȣ�Sr��λ�����ڱ��ĵ�___����___�壬�������ȣ�SrO2������Ԫ�صĻ��ϼ�Ϊ______��
��2���������ڳ����º�ˮ��Ӧ�����������ɣ�д���÷�Ӧ�Ļ�ѧ����ʽ______��
��3�������Ⱥܻ��ã��ڿ������ױ��������ɱ�����______�У�����ţ���
��ˮ �ھƾ� ��ú��
��4���ȵ�����������ơ���֪��CaCl2 ������ˮ��CaF2������ˮ����д�������Ⱥͷ����Ʒ�Ӧ�����ӷ���ʽ______��
��5�������������±���SrSO4��C�۵Ļ�����2molSrSO4��ȫ��Ӧ��ֻ��S����ԭ��ת��16mol���ӣ�ͬʱֻ����һ�ֿ�ȼ�����壬�÷�Ӧ�Ļ�ѧ����ʽ��______��
��6����t��ʱ��ijSr��OH��2��ϡ��Һ��c��H+��=10��amolL��1��c��OH����=10��bmolL��1����֪a+b=12�������Һ����μ��� pH=X �����ᣬ��û����Һ�IJ���pH�����ʾ��
Sr��OH��2��Һ�����/mL | ��������/mL | ��Һ�� pH | |
�� | |||
�� | 22.00 | 18.00 | 7 |
�� | 22.00 | 22.00 | 6 |
��������Һ���ǰ�������仯����XΪ______����������գ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��WΪ����������Ԫ�أ������ڱ��е����λ������ͼ��ʾ������˵��һ����ȷ����
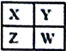
A. ��XԪ������Ȼ���д���ͬ�������壬��W��ͬ����Ԫ���У�ԭ�Ӱ뾶��С
B. ��HmXOnΪǿ�ᣬ��X ���⻯������ˮһ�������ԣ�m��n��Ϊ��������
C. ������Ԫ�ؾ�Ϊ��������Z������������Ӧ��ˮ����һ��Ϊǿ��
D. ������Ԫ�ؾ�Ϊ�ǽ�������YԪ���ڻ������в�������ʾ�����ϼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��й��������ϵ������������ȷ���ǣ� ��
ѡ�� | �� | ���ϵ | �������� |
A | C60��C70��C540 | ͬλ�� | ����ֻ���Ǽ��Թ��ۼ� |
B | ���顢2��2���������� | ͬ���칹�� | ���³�ѹ�³���̬ |
C |
| ͬ�������� | ������������ʱ�Ĵ��� |
D | ���ᡢӲ֬�� | ͬϵ�� | �ܷ���������Ӧ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���NaCl����NaOH����NH3��H2O����CH3COOH��Һ����BaSO4����H2O����HCl����H2SO4����CO2����ƾ���Һ������д��Żش�
��1��pH��ȵĢڵ���Һ�͢۵���Һ�������ˮϡ����ͬ������pH�����______��
��2����pH��Ϊ2�Ģܡ��ߡ����������ʵ���Һ�����ʵ���Ũ�ȴ�С��˳��Ϊ______�����ֱ������������кͺ������ʵ���NaOH����Һ����������Һ������ֱ�Ϊa��b��c����a��b��c�Ĵ�С��ϵ��__________��
��3��ij�¶�ʱ��1mol��L-1�Ĵ�����Һ����ƽ�ⳣ��Ϊ1.0��10-8����ƽ��ʱ����Һ��������Ũ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������У��������������������( )
A. CH3CH3 B. CH2=CHCl
C. CH3CH2OH D. CH3COOCH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25���£�����0.1mol��L-1��H2SO4��0.1 mol��L-1һԪ����HA������Һ
��1��ʵ����0.1 mol��L-1һԪ����HA ��pHΪ4����HA�ĵ���ƽ�ⳣ��Ka= ��
��2��0.1mol��L-1��H2SO4��ˮ�������C(H+)Ϊ ��
��3����0.1mol��L-1�������м���һ�������pH=13��NaOH��Һ����Ӧ����Һ��pHΪ2��������NaOH��Һ������������Ϊ ��
��4����0.1 mol��L-1һԪ����HA����һ�������ˮ���ڴ˹����У�������ֵ������ ��
��c(H+) �� ����ȣ����� ��c(OH-) �� Ka ��c(A-)/ c(HA) ��n(A-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��(CuFeS2)����Ҫ�Ŀ�أ��Ի�ͭ��Ϊԭ��������ʽ�Ȼ�ͭ������(Fe2O3)���ϵĹ���������ͼ��ʾ��
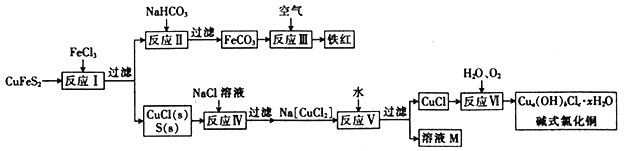
��֪��a��b��c��x��Ϊ������
��1������������ж�ι���������ʱ�õ��IJ�������Ϊ__________��__________��__________��
��2����Ӧ�������ӷ���ʽΪ__________________���÷�Ӧ�Ļ�ԭ����__________(�ѧʽ����ͬ)������������__________��
��3����Ӧ�������ӷ���ʽΪ___________________________��
��4����Ӧ������45~50���������½��е����÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ____________��
��5��Ϊ�ⶨ�Ƶõļ�ʽ�Ȼ�ͭ����ɣ�ijʵ��С���������ʵ�飺
����ȡ��Ʒ9.30g��������ϡHNO3�ܽ�����100.00mL��ҺA;
��ȡ25.00mL��ҺA����������AgNO3��Һ���õ�AgCl����1.435g;
����ȡ25.00mL��ҺA������pHΪ4~5����Ũ��Ϊ0.40mol��L-1��EDTA(Na2H2Y��2H2O)����Һ�ζ�Cu2+(���ӷ���ʽΪCu2++H2Y2-=CuY2-+2H+)���ζ����յ������ı���Һ50.00mL��ͨ������ȷ������Ʒ�Ļ�ѧʽΪ_________________________(�ѧʽ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com