
【题目】己知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如下图所示,下列说法一定正确的是
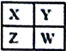
A. 若X元素在自然界中存在同素异形体,则W在同周期元素中,原子半径最小
B. 若HmXOn为强酸,则X 的氢化物溶于水一定显酸性(m、n均为正整数)
C. 若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
D. 若四种元素均为非金属,则Y元素在化合物中不可能显示正化合价
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
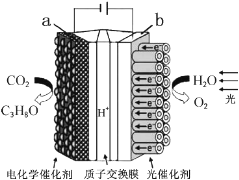
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X,Y,Z,W四种元素,它们的原子序数分别为6、10、11、17,下列判断错误的是( )
A.X,W能形成共价化合物
B.Z,W能形成离子化合物
C.Y分子中存在共价键
D.Y和Z不能形成化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
B.大理石与稀硝酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.硫酸溶液与氧氧化钡溶液混合:H++SO42-+Ba2++OH-=H2O+BaSO4↓
D.MgC12溶液与过量氨水反应:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如工艺流程法制得。
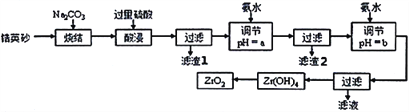
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
(1)已知Zr元素的原子序数是40,请写出它在周期表中的位置:____________________________。
(2)烧结时ZrSiO4发生反应的化学方程式为__________________________;滤渣1的化学式为__________。
(3)调节pH=a时,a的范围应该是__________________;用氨水调节pH=b时,所发生反应的离子方程式为_______________________________________。
(4)本题的流程中,一共有三步过滤操作,北中最后一步过滤所得的Zr(OH)4沉淀需要洗涤,证明该沉淀已经洗涤干净的最佳操作方法是:______________________________________。
(5)工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:________________。
(6)一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入乙烷,写出负极的电极反应式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
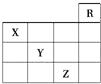
①X元素的原子有二个电子层,处于周期表的第15个纵行;②Z的原子序数为31,单质常温下为液体;③气态氢化物水溶液的酸性 X<Y<Z;④X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐;⑤Z的原子序数比Y大19,Y的原子序数比X大 9。
A. 只有② B. 只有①③④⑤ C. 只有①②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是______。
A.14N与15N为同种核素 B.14N的第一电离能小于14C
C.15NH3与14NH3均能形成分子间氢键 D.14CH315NH2与CH3CH2NH2互为同系物
(2)15N的价层电子排布图为_______,15NH4Cl的晶胞与CsCl相同,则15NH4Cl晶体中15NH4+的配位数为_____;15NH4+中15N的杂化轨道类型为_________。
(3)工业上电解法处理亚硝酸盐的模拟工艺如图:
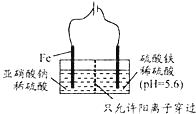
已知:阳极区发生化学反应:2N02+8H++6Fe2+═N2↑+6Fe3++4H2O
①阳极电极反应方程式是______(不考虑后续反应);
②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为________(填化学式); 该现象表明c(H+)越大,H+氧化性越_______;
③若电解时电路中有0.6mol电子转移,且NaNO2有剩余,则电解池中生成________molNa2SO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com