
【题目】若将铝粉分别加入下列溶液中,能放出氢气,且可能大量共存的是( )
A.H+、Ba2+、Cl﹣、NO3﹣
B.NH4+、CO3﹣、NO3﹣、Na+
C.NO3﹣、K+、[Al(OH)4]﹣、OH﹣
D.Na+、Ba2+、Mg2+、HCO3﹣
科目:高中化学 来源: 题型:
【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
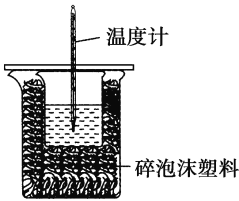
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:

已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、_____________________。
(2)操作Ⅰ的目的是_______________________和调节溶液的PH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是___________________________________________________________________。
(3)通过煅烧MnSO4·H2O可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余质量变化的曲线如图所示。根据图中数据可得MnxO4中x的值为______________。A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,写出该过程中发生反应的化学方程式:______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因创制新型抗疟药——青蒿素(结构如图)和双氢青蒿素的贡献,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,荣获2015年诺贝尔奖生物学或医学奖。下列有关青蒿素的叙述不正确的是

A. 分子式为C15H22O5
B. 它在乙醚中的溶解度大于在水中的溶解度
C. 能发生取代反应、水解反应、加成反应,不能发生氧化反应
D. 该物质不稳定,容易受到热和还原性物质的影响而发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氕化锂、氘化锂、氚化锂都可作为火箭的引燃剂。下列说法正确的是( )
A. 1H、D+、T2互为同位素
B. LiH、LiD、LiT含有的电子总数分别为 3、4、5
C. 7LiH、7LiD、7LiT的摩尔质量之比为1:1:1
D. 一个 D原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是一种重要的化工原料,主要成分是CuFeS2,另外还有少量的氧化铝、二氧化硅及水分,通过化学工艺可获得许多化工产品。
(1)铜元素位于元素周期表中_________(填写周期、族);基态Fe原子的价层电子轨道表达式为_____;
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是_________(必要化学用语及文字简答)。
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是__________。
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式______________(如有配位键,请 用“→”表 示 )。(5)黄铜矿在空气中高温灼烧可以得到固体混合物和废气,固体混合物中有X和Y两化合物。固体化合物X的晶胞模型如图甲所示:
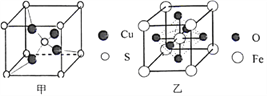
①化合物X的化学式:___________;
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为___________;SO3分子空间构型是___________。
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类生产和生活中必不可少的重要金属(如图)。

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___。计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%…是指各同位素的____。
(2)铁原子中有___种能量不同的电子,铁原子次外层的电子云有____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为_________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于阴极,电解质溶液是____。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:___Fe(NO3)3+___NaOH+____Cl2→___Na2FeO4+ ___NaNO3+___NaCl+___H2O;高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是_______________。
(6)0.03mol的铁加到过量的 HNO3中,加热,铁完全溶解,若生成 NO、NO2的混和气体共1.12L(标准状况),将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是 D原子最外层电子数的3倍。试回答:
(1)写出元素的名称:A________、C________。
(2)写出由B、D组成的两种化合物的电子式分别为:_______、_______。
(3)C的固态氧化物属于_______晶体,写出表示C的氧化物的一种重要的工业用途_______。
(4)A、C的最高价氧化物对应水化物中酸性较强的是_______ (写水化物的分子式)。
(5)写出C的氧化物与D的最高价氧化物对应水化物反应的离子方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com