
【题目】某烯烃与H2发生加成反应后得到的产物是CH3CH(CH3)2.
(1)该产物的系统命名的名称为______,写出该产物的同分异构体的结构简式______
(2)光照条件下,该产物与氯气反应,生成含两个甲基的一氯代物,写出反应的化学方程式______________________ ,反应类型是______________
(3)原来烯烃的结构简式为:______,系统命名的名称为______________
(4)写出该烯烃一定条件下发生加聚反应的方程式:_____________;
(5)写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式:____; 反应类型是__________
【答案】 2-甲基丙烷 CH3CH2CH2CH3 CHCH(CH)CH+Cl→CHCH(CH)CH2Cl+HCl 取代反应 CH2=C(CH)CH 2-甲基-1-丙烯(2-甲基丙烯) n CH2=C(CH3)2 →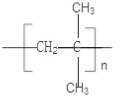 CH2=C(CH3)2+Br2 →CH2Br-CBr(CH3)2 加成反应
CH2=C(CH3)2+Br2 →CH2Br-CBr(CH3)2 加成反应
【解析】(1)CH3CH(CH3)2系统命名的名称为2-甲基丙烷;2-甲基丙烷的同分异构体的结构简式CH3CH2CH2CH3;(2)光照条件下,该产物与氯气反应,生成含两个甲基的一氯代物,反应的化学方程式CH3CH(CH3)CH3+Cl2![]() CH3CH(CH3)CH2Cl+HCl ,反应类型是取代反应;(3)原来烯烃的结构简式为: CH2=C(CH3)2,系统命名的名称为:2-甲基-1-丙烯(2-甲基丙烯);(4)该烯烃一定条件下发生加聚反应的方程式: n CH2=C(CH3)2 →
CH3CH(CH3)CH2Cl+HCl ,反应类型是取代反应;(3)原来烯烃的结构简式为: CH2=C(CH3)2,系统命名的名称为:2-甲基-1-丙烯(2-甲基丙烯);(4)该烯烃一定条件下发生加聚反应的方程式: n CH2=C(CH3)2 →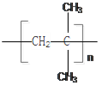 (5)原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式: CH2=C(CH3)2+Br2 →CH2Br-CBr(CH3)2,属于加成反应。
(5)原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式: CH2=C(CH3)2+Br2 →CH2Br-CBr(CH3)2,属于加成反应。


科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )
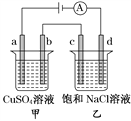
A. 电路中电子流向:负极→d→c→b→a→正极
B. a、c两极产生气体的物质的量相等
C. SO42-向b电极运动,Cl-向c电极运动
D. 通电后乙烧杯滴入酚酞溶液d极会变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系,回答下列问题。

(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出反应⑧的化学方程式和反应④、⑤的离子方程式。
⑧_____________________________________________________;
④_____________________________________________________;
⑤_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有20mL浓度为0.04mol·L-1的Na2SO3溶液恰好与10mL浓度为0.02mol·L-1的K2A2O7溶液完全反应。已知Na2SO3可被K2A2O7氧化为Na2SO4,则元素A在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内。在玻璃反应管内装入适量水(使钠块不与水接触)。实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起,使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
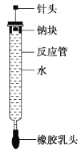
(1)钠与水反应的离子方程式为__________________________________________________。
(2)实验中“钠块熔化为闪亮的小球”说明_____________________;向烧杯中的溶液中滴加____________,溶液变红,说明钠与水反应生成碱性物质。
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为____________g(设当时实验条件下气体摩尔体积为V mL/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
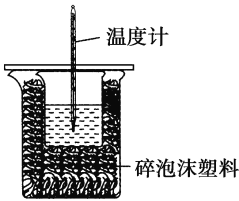
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )
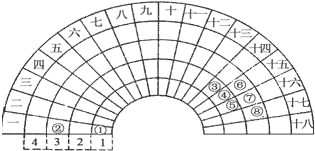
A. ③元素形成的单质晶体均属于原子晶体
B. ④元素的气态氢化物易液化,是因为其分子间存在氢键
C. ②、⑦、⑧对应的简单离子半径依次减小
D. ②⑤⑦三种元素形成的盐溶液在 25℃时的 pH值为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因创制新型抗疟药——青蒿素(结构如图)和双氢青蒿素的贡献,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,荣获2015年诺贝尔奖生物学或医学奖。下列有关青蒿素的叙述不正确的是

A. 分子式为C15H22O5
B. 它在乙醚中的溶解度大于在水中的溶解度
C. 能发生取代反应、水解反应、加成反应,不能发生氧化反应
D. 该物质不稳定,容易受到热和还原性物质的影响而发生变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com