
【题目】下列对有机物的命名,不正确的是
A.2-乙基丁烷B.2,2-二甲基丙烷C.2-甲基丁烷D.2,3-二甲基丁烷
科目:高中化学 来源: 题型:
【题目】电镀废液的综合利用有利于减少重金属对水体的污染。某实验小组用以下流程模拟利用一定量工业电镀废液(强酸性,含Cr2O72-、杂质Cu2+等)制备水溶性皮革鞣剂Cr(OH)SO4。回答下列问题:
(已知lg2=0.3,Ksp[ Cr(OH)3]=6.4×10-31, Ksp[ Cu(OH)2]=2×10-20 )

(1)加Na2SO3前先将废液调为弱酸性溶液的原因是__________________,写出废液中加Na2SO3时发生反应的离子方程式_____________。
(2)步骤①须保持温度在30~50℃,可采用的措施是___________________。
(3)步骤②的操作名称是___________。
(4)若在步骤②中,使Cr3+完全沉淀,则溶液的pH范围为______________,
[已知溶液中c(Cu2+)=2×10-4mol·L-1,完全沉淀时c(Cr3+)<10-5 mol·L-1]
(5)粗产品中含有微量CrO42-,工业选择的试剂X应满足的条件是__________。
A.与水互不相溶 B.CrO42-在X中溶解度小
C.Cr(OH)SO4在X中溶解度大 D.Cr(OH)SO4与X不反应
(6)若工业电镀废液含0.1mol Cr2O72-,最终制得产品31.35g,则产率为__________。
(7)酸性条件下,蔗糖还原Na2Cr2O7也可制备Cr(OH)SO4:
Na2Cr2O7+NaHSO4+C12H22O11→Cr(OH)SO4+Na2SO4+H2O+CO2(未配平)
①反应中每生成1molCr(OH)SO4,理论上需要C12H22O11_________mol
②将生成液降温至17℃以下,静置,过滤,在80℃时蒸发滤液,得到标准的工业产品,该产品中混有的主要杂质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯、乙醇、乙酸都是常见的有机物,下列说法正确的是
A. 甲烷中混有乙烯,用酸性高锰酸钾溶液除去
B. 乙醇不能使酸性高锰酸钾溶液褪色
C. 酒越陈越香与酯化反应有关
D. 乙醇与乙酸酯化反应时用稀硫酸作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,气体被氧化的是
A. 乙烯使酸性KMnO,溶液褪色 B. CO2通入Na2SiO2溶液产生胶状沉淀
C. 用湿润的淀粉-KI试纸检验Cl2 D. 用CuSO4溶液吸收含H2S的工业废气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
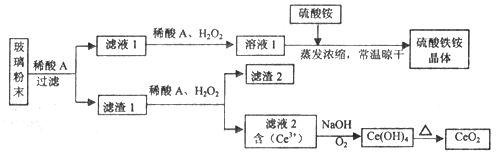
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com