
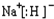 ;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑. 分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,则E为S元素;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Al,处于的第二周期,最外层电子数为4,故B为碳元素;元素C在同周期的主族元素中原子半径最大,处于IA则,原子序数大于碳,故C为Na;元素A的单质在常温下呈气态,原子序数小于碳,故A为H元素,据此解答.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,则E为S元素;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Al,处于的第二周期,最外层电子数为4,故B为碳元素;元素C在同周期的主族元素中原子半径最大,处于IA则,原子序数大于碳,故C为Na;元素A的单质在常温下呈气态,原子序数小于碳,故A为H元素.
(1)由上述分析可知,B为C元素、C为Na,D为Al,在元素周期表中的位置为:第三周期ⅢA族,
故答案为:C;Na;第三周期ⅢA族;
(2)已知6.8gH2S的完全燃烧放出0.2a kJ的热量,1molH2S燃烧放出的热量为0.2akJ×$\frac{1mol×34g/mol}{6.8g}$=a kJ,A2S燃烧热的热化学方程式:H2S (g)+$\frac{3}{2}$ O2 (g)=SO2 (g)+H2O (l)△H=-a kJ•mol-1,
故答案为:H2S (g)+$\frac{3}{2}$ O2 (g)=SO2 (g)+H2O (l)△H=-a kJ•mol-1;
(3)CA为NaH,属于离子化合物,电子式为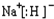 ,NaH与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑,
,NaH与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为: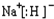 ;NaH+H2O=NaOH+H2↑.
;NaH+H2O=NaOH+H2↑.
点评 本题考查结构性质位置关系应用,注意燃烧热热化学方程式的书写,(3)中金属氢化物在中学基本不涉及,属于易错点.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铯晶体中,每1个Cs+与其它8个Cs+等距离紧邻 | |
| B. | 金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子 | |
| C. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同素异形体,性质相似 | |
| B. | 水电站把机械能转化为电能,而核电站把化学能转化成电能 | |
| C. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| D. | C(石墨,s)=C(金刚石,s)△H>0,所以石墨较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | - | Cl- | |
| ② | KClO3 | 浓盐酸 | - | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中①组的反应可能有一种或两种元素被氧化 | |
| D. | 表中③组反应的离子方程式为:2MnO${\;}_{4}^{-}$+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑥⑧ | C. | ②⑤⑦⑧ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c({H}^{+})}$>1.0×10-7mol/L | |
| B. | 往滤液中加水稀释,所有离子浓度都会减小 | |
| C. | c(H+)+c(NH4+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2CO3>H2SiO3 | B. | 稳定性:HF<H2O<NH3 | ||
| C. | 离子半径:Na+>F->Al3+ | D. | 沸点:HI>HBr>HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com