
| A.燃烧法测定有机物组成时先用碱石灰测CO2质量,再用浓H2SO4测H2O质量 |
| B.制硝基苯需要配制混合酸,应先加浓硝酸再加浓硫酸 |
| C.检验淀粉在稀硫酸作用下是否发生水解,应在水解液中先加入NaOH溶液中和后再加入银氨溶液共热 |
| D.检验丙烯醛(CH2=CH—CHO)中的官能团时,应先用新制Cu(OH)2试剂检验醛基再用KMnO4溶液检验碳碳双键 |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.标准液在“0”刻度线以上,未予调整就开始滴定 |
| B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗 |
| C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视 |
| D.酚酞指示剂由无色变为红色时立即停止滴定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④③① | B.②④①③ | C.②①④③ | D.④②①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10.00mL | B.15.00mL | C.小于10.00mL | D.大于10.00mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用酸式滴定管量取20.0mL酸性高锰酸钾溶液; |
| B.用米汤直接检验食盐中是否有碘元素; |
| C.用酚酞检验纯碱中是否含有烧碱; |
| D.多次盐析或多次渗析的方法分离提纯蛋白质; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | Na2SO4 | (NH4)2SO4 | CaCl2 | MgCl2 | CaSO4 |
| 36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
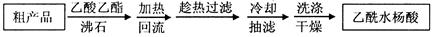
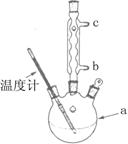
| A.称取0.300 g样品。 |
| B.将样品与25 mL 4 mol·L-lNaOH溶液在三颈烧瓶中混合,水浴加热回流l小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。 |
| C.在三颈烧瓶中加入50 mL 2 mol·L-l HNO3,混合均匀。 |
| D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.用托盘天平准确称取所需的Na2CO3固体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.为了提高甲烷与氯气的反应速率,用阳光直射反应容器 |
| B.为了验证甲烷与氯气的反应产物之一为氯化氢,水槽中改用AgNO3溶液 |
| C.用溴水鉴别乙烷和乙烯 |
| D.用高锰酸钾溶液除去乙烷中的乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com