
【题目】在一定体积的容器中加入1.5mol氙气(Xe)和7.5mol氟气(F2),于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是
A.1∶2 B.1∶3 C.1∶4 D.1∶6
科目:高中化学 来源: 题型:
【题目】两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是( )
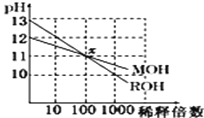
A. MOH是一种弱碱
B. 在x点,c(M+)=c(R+)
C. 稀释前,c(ROH)="10" c(MOH)
D. 稀释前MOH溶液和ROH溶液中由水电离出的c(OH﹣)后者是前者的 10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取电解二氧化锰(EMD)的工艺流程如下:
I.将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II.向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III.过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV.将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是________。完成酸浸过程中反应的离子方程式:
![]() FeS2+
FeS2+![]() MnO2+
MnO2+![]() _____=
_____=![]() Mn2++
Mn2++![]() Fe2++ S + SO42-+
Fe2++ S + SO42-+![]() ____
____
(2)加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:________。(结合离子方程式解释)
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是__极(填“a”或“b”),生成EMD的电极反应式是_________。
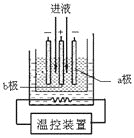
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是_______(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列基态原子或离子的电子排布式错误的是( )
A. K:1s22s22p63s23p64s1 B. F-:1s22s22p6
C. 26Fe:1s22s22p63s23p63d54s3 D. Kr:1s22s22p63s23p63d104s24p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电负性的大小也可以作为判断金属性和非金属性强弱的尺度,下列关于电负性的变化规律正确的是
A. 周期表中同周期元素从左到右,元素的电负性逐渐增大
B. 周期表中同主族元素从上到下,元素的电负性逐渐增大
C. 电负性越大,金属性越强
D. 电负性越小,非金属性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如下图所示的转化关系,且ΔH=ΔH1+ΔH2,则X、Y可能是
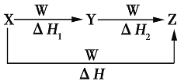
①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2
A.①②③④⑤ B.②④⑤ C.①③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是________元素(填元素名称,后面小题相同),它在周期表中的位置为______________。
(2)乙是________元素,写出与乙同主族第六周期元素对应碱的电子式___________________。
(3)丙是________元素,最高价氧化物对应水化物的化学式是_________________;
(4)丁是________元素,甲与丁两种元素形成既有离子键又有共价键物质的化学式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
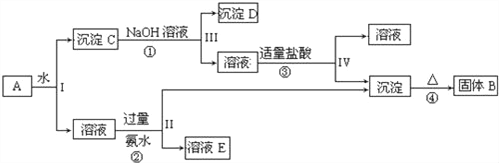
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_____.
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B______;C________;沉淀D_____;溶液E________.
(3)写出①、②、③、④四个反应方程式
①_________________________;
②________________________;
③________________________;
④________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com