
【题目】下列说法中正确的是
A. 溶解度大的化合物一定是强电解质
B. 胶体与溶液的本质区别是分散剂粒子大小的不同
C. 物质在发生化学反应的过程中,都伴随着能量的变化
D. 金属的冶炼必须在高温下进行
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列化学实验能够获得成功的是( )
A. 只用溴水为试剂, 可以将苯、乙醇、己烯、四氯化碳四种液体区分开来。
B. 将无水乙醇加热到 170℃时, 可以制得乙烯
C. 苯酚和福尔马林在沸水浴中加热可以制取酚醛树脂
D. 乙醇、冰醋酸和 2 mol/L 的硫酸混合物, 加热可以制备乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述符合事实的是
A. 乙烯使溴水和酸性高锰酸钾溶液褪色的反应都属于氧化反应
B. 乙酸和乙醇均能与NaOH溶液发生反应
C. 苯与溴水混合后加入FeBr3做催化剂,可发生取代反应生成溴苯
D. C5H11Br有8种同分异构体,它们的熔点、沸点各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+Y2(g)![]() 2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL-1、0.3molL-1、0.2molL-1,反应达到平衡时,各物质浓度可能是 ( )
2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL-1、0.3molL-1、0.2molL-1,反应达到平衡时,各物质浓度可能是 ( )
A.c(X)=0.2molL-1 B.c(Y2)=0.35molL-1 C.c(Y2)=0.2molL-1 D.c(Z)=0.4molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2 (g) ![]() CO(g)+Cl2 (g) △H>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO 的浓度 ④加催化剂 ⑤恒压通入惰性气体,能提高COCl2 转化率的是( )
CO(g)+Cl2 (g) △H>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO 的浓度 ④加催化剂 ⑤恒压通入惰性气体,能提高COCl2 转化率的是( )
A.①⑤ B.①② C.③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol · L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol · L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是

A. 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B. 点③时:c(Na+)=c(CH3COO-)>c(H+)
C. 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:_______________________________________。
【实验验证】实验装置及实验中使用的试剂如图:

在装入药品前,甲同学检查装置A 的气密性,方法是________________________________________。
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设_____,理由是______________________________________________________。
(3)如果假设3 正确,填写下表中的实验现象:
装置 | B | F | G |
实验现象 | _____ | _____ | _____ |
装置C 的作用是___________________________,写出装置C中发生反应的离子方程式__________________________________________________。
(5)装置D 的作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),达到平衡,若其它条件不变,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法不正确的是( )
2CO(g)+2H2(g),达到平衡,若其它条件不变,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法不正确的是( )
A.正、逆反应速率都加快 B.氢气的浓度与原平衡比减少
C.甲烷的物质的量增加 D.重新平衡时c(CO2) /c(CO)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:
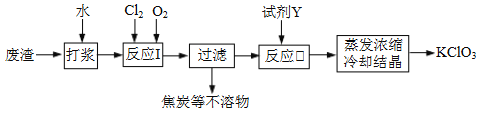
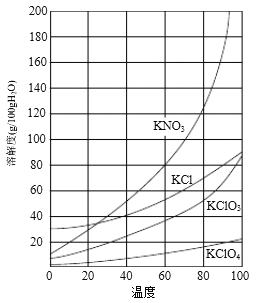
几种物质的溶解度如下图:
⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
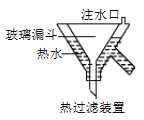
①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com