
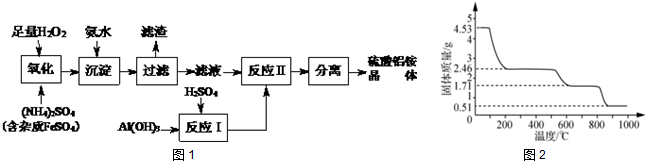
分析 由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液pH值,使Fe3+转化为Fe(OH)3过滤除去,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,最终得到硫酸铝铵晶体.
(1)加入过氧化氢将溶液中Fe2+氧化为Fe3+;
(2)加入氨水调节溶液pH值,使Fe3+转化为Fe(OH)3;
(3)过滤后的滤液中可能含有Fe3+,用KSCN溶液检验是否含有Fe3+;
(4)流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;
反应中各元素化合价未变,没有发生氧化还原反应,根据原子守恒配平,可知缺项物质为水;
(5)4.53g硫酸铝铵晶体的物质的量为$\frac{4.53g}{453g/mol}$=0.01mol,4.53g硫酸铝铵晶体中水的质量为0.01mol×12×18g/mol=2.16g,加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g,故未完全失去结晶水,计算晶体中剩余结晶水的质量,进而计算剩余固体中n[(NH4)Al(SO4)2]:n(H2O),据此书写化学式.
解答 解:由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液pH值,使Fe3+转化为Fe(OH)3过滤除去,过滤后滤液主要含硫酸铵,氢氧化铝与硫酸混合反应生成硫酸铝溶液,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,最终得到硫酸铝铵晶体.
(1)加入过氧化氢将溶液中Fe2+氧化为Fe3+,反应离子方程式为:H2O2+2Fe2++2H+═2 Fe3++2H2O,
故答案为:H2O2+2Fe2++2H+═2 Fe3++2H2O;
(2)加入氨水调节溶液pH值,Fe3+使转化为Fe(OH)3,反应方程式为:Fe2(SO4)3+6NH3•H2O═2Fe(OH)3↓+3(NH4)2SO4
故答案为:沉淀杂质Fe3+;Fe2(SO4)3+6NH3•H2O═2Fe(OH)3↓+3(NH4)2SO4;
(3)过滤后的滤液中可能含有Fe3+,取少许滤液于试管中,加几滴KSCN溶液,若溶液不变红色,则杂质已除尽.
故答案为:加几滴KSCN溶液,若溶液不变红色;
(4)流程中“分离”是从溶液中获得晶体,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,
反应中各元素化合价未变,没有发生氧化还原反应,根据原子守恒,可知缺项物质为水,配平后反应方程式为:2Al2(NH4)2(SO4)4•24H2O═2Al2O3+4NH3↑+8SO3↑+50H2O,
故答案为:蒸发浓缩、冷却结晶;2、4、8、50H2O;
(5)4.53g硫酸铝铵晶体的物质的量为$\frac{4.53g}{453g/mol}$=0.01mol,
4.53g硫酸铝铵晶体中水的质量为0.01mol×12×18g/mol=2.16g,
加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g
剩余固体中结晶水的物质的量为$\frac{2.16g-2.07g}{18g/mol}$=0.005mol.
剩余固体中n[(NH4)Al(SO4)2]:n(H2O)=0.01mol:0.005mol=2:1,
故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O,
故答案为:(NH4)2Al2(SO4)4•H2O.
点评 本题属于物质制备工艺流程题目,考查镁铝及其化合物的性质、对工艺流程理解、常用化学用语、盐类水解、物质的分离提纯与离子检验、化学计算等,综合性较大,难度较高,需要学生具备扎实的基础与运用知识分析解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
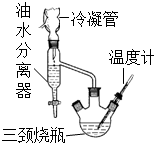 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Al(OH)3 | C. | AlO2- | D. | Al3+ Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4-在反应中失去5mol电子 | ||
| C. | 从反应中看出草酸性质很不稳定 | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 等体积等物质的量浓度的NaCl和NaClO溶液中离子总数:N前<N后 | |
| C. | 1mol/L的(NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) | |
| D. | 0.1mol/LNaHX溶液pH=3,则此溶液中有:c(HX-)>c(H2X)>c(X2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1 108 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 3mol/L KCl溶液 | B. | 75 mL 2mol/L CaCl2溶液 | ||
| C. | 100 mL 0.5mol/L BaCl2溶液 | D. | 50mL 1mol/L AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com