
【题目】钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图所示。
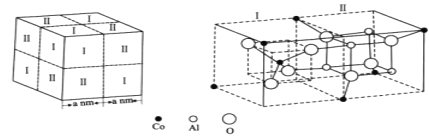
基态Co原子的价电子排布图为___。该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,NA为阿伏加德罗常数的值,钴蓝晶体的密度为___g·cm-3(列计算式)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,FeS、CuS的溶度积常数分别为6.3×10-18 mol2·L-2、1.3×10-36 mol2·L-2。下列说法中,错误的是( )
A.25℃时,FeS的溶解度大于CuS的溶解度
B.反应CuSO4+H2S=CuS↓+H2SO4不能发生
C.可用FeS作沉淀剂除去废水中的Cu2+
D.25℃时,饱和CuS溶液中,Cu2+的浓度为![]() ×10-18 mol·L-1
×10-18 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“烟气脱硫”是环境治理的重要工程,两种常见脱硫方法如下。回答相关问题:
方法I:用亚硫酸盐吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数与溶液pH的变化关系如图所示。
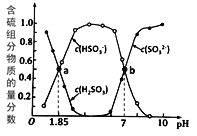
(1)若选用 (NH4)2SO3作为吸收液(已知NH3·H2O 的电离常数Kb=1.74×10-5):
①H2SO3的pKa1=________( pKa1 = -lgKa1);
②(NH4)2SO3溶液呈________(填“酸性”、“碱性”或“中性”),理由是________________;
③图中b点溶液中n(HSO3- ) : n(NH4+) =_________。
(2)若选用0.1mol/L 的Na2SO3作为吸收液,吸收过程中,下列有关粒子浓度关系一定正确的是(忽略溶液体积的变化)_________。
A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-)
B.NaHSO3溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
C.当吸收液呈中性时:2c(SO32-)+c(HSO3-)=0.2mol/L
D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
方法II:用含铬废水吸收烟气中的SO2。吸收原理如图所示:
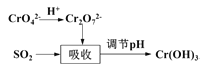
(3)“吸收”中反应的离子方程式为____________________
(4)欲使废水中的铬元素完全转化为Cr(OH)3沉淀,应调节pH的范围为____。(常温下Ksp[Cr(OH)3]=1.0×10-32)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.制备FeBr2固体
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将干燥、纯净的CO2气流通入D中,再将铁粉加热至600-700℃,E管中铁粉开始反应。不断将d中液溴滴入温度为100-120℃的D中,经过一段时间的连续反应,在不锈钢管内产生黄绿色鳞片状溴化亚铁。
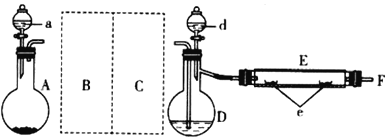
(1)若在A中盛固体CaCO3,a中盛有6mol/L的盐酸。为使导入D中的CO2为干燥纯净的气体,图中C处的洗气瓶中装有浓硫酸,则B中为___,若进入E装置中的CO2未干燥,则可能发生的副反应的化学方程式为___。
(2)E管中的反应开始前通入CO2的主要作用是___;E管中的反应开始后持续通入CO2的主要作用是___。
II.探究FeBr2的还原性
(3)现实验需要90mL0.2mol/LFeBr2溶液,取上述反应制得的FeBr2固体配制该溶液,所需仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器是___。
(4)已知:Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色。Cl2既能氧化Br-,也能氧化Fe2+。取10mL上述FeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为血红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+___Br-(填“>”或“<”)。
(5)若向30mL步骤(3)的FeBr2溶液中通入标准状况下179.2mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈___色,写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。
回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(2)D的氢化物比C的氢化物的沸点_____(填"高"或"低"),原因____________。
(3)E元素在周期表的位置是______________。
(4) 画出D的核外电子排布图_________________________________________,这样排布遵循了______________原理、____________原理和____________规则。
(5)用电子式表示B的硫化物的形成过程:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)与时间(t)关系如右图。反应中镁和铝的
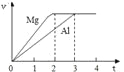
A. 物质的量之比为3:2 B. 质量之比为3:2
C. 摩尔质量之比为2:3 D. 反应速率之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如下图。
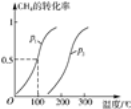
①已知100 ℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____。
②图中的P1___P2(填“<”、“>”或“=”),100 ℃时平衡常数为____。
③在其他条件不变的情况下降低温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
(2)在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) Ⅱ
CH3OH(g) Ⅱ
①该反应的ΔH______0,ΔS_____0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是(____)
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com