
【题目】“烟气脱硫”是环境治理的重要工程,两种常见脱硫方法如下。回答相关问题:
方法I:用亚硫酸盐吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数与溶液pH的变化关系如图所示。
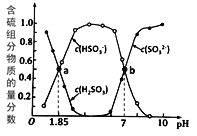
(1)若选用 (NH4)2SO3作为吸收液(已知NH3·H2O 的电离常数Kb=1.74×10-5):
①H2SO3的pKa1=________( pKa1 = -lgKa1);
②(NH4)2SO3溶液呈________(填“酸性”、“碱性”或“中性”),理由是________________;
③图中b点溶液中n(HSO3- ) : n(NH4+) =_________。
(2)若选用0.1mol/L 的Na2SO3作为吸收液,吸收过程中,下列有关粒子浓度关系一定正确的是(忽略溶液体积的变化)_________。
A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-)
B.NaHSO3溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
C.当吸收液呈中性时:2c(SO32-)+c(HSO3-)=0.2mol/L
D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
方法II:用含铬废水吸收烟气中的SO2。吸收原理如图所示:
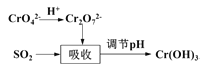
(3)“吸收”中反应的离子方程式为____________________
(4)欲使废水中的铬元素完全转化为Cr(OH)3沉淀,应调节pH的范围为____。(常温下Ksp[Cr(OH)3]=1.0×10-32)
【答案】1.85 碱性 SO32-的水解程度大于NH4+的水解程度 1:3 BC 3SO2+Cr2O72-+2H+ =2Cr3++3SO42-+H2O ≥5
【解析】
(1)①H2SO3的第一步电离平衡常数Ka1=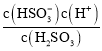 ,据此结合图像计算;
,据此结合图像计算;
②(NH4)2SO3溶液中存在铵根的水解和亚硫酸根的水解,若铵根水解程度大则显酸性,若亚硫酸根水解程度大则显碱性;
③结合电荷守恒和图像进行判断;
(2)A.Na2SO3作为吸收液,溶液中存在第一步水解:![]() ,第二步水解:
,第二步水解:![]() ,且一步水解程度远大于第二步水解;
,且一步水解程度远大于第二步水解;
B.NaHSO3溶液中存在电离平衡:![]() ,和水解平衡:
,和水解平衡:![]() ,据此进行分析;
,据此进行分析;
C.根据电荷守恒进行分析;
D.根据电荷守恒进行分析;
(3)根据产物可知该过程中Cr2O72-被还原成Cr3+,二氧化硫做还原剂;
(4)当离子浓度![]() ,可认为该离子完全沉淀;然后根据Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)进行计算;
,可认为该离子完全沉淀;然后根据Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)进行计算;
(1)①Ka1=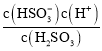 ,根据图像可知当pH=1.85时,n(HSO3- ) =n(H2SO3),也即c(HSO3- ) =c(H2SO3),所以Ka1=10-1.85,则pKa1=1.85,故答案为:1.85;
,根据图像可知当pH=1.85时,n(HSO3- ) =n(H2SO3),也即c(HSO3- ) =c(H2SO3),所以Ka1=10-1.85,则pKa1=1.85,故答案为:1.85;
②NH3·H2O 的电离常数Kb=1.74×10-5,则铵根的水解平衡常数为![]() ,亚硫酸根的水解平衡常数
,亚硫酸根的水解平衡常数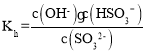 根据图像可知当pH=7时,n(HSO3-)=n(SO32-),即c(HSO3-)=c(SO32-),所以亚硫酸根的水解平衡常数为1×10-7,大于铵根的水解平衡常数,所以亚硫酸根的水解程度大,溶液显碱性,故答案为:碱性;SO32-的水解程度大于NH4+的水解程度;
根据图像可知当pH=7时,n(HSO3-)=n(SO32-),即c(HSO3-)=c(SO32-),所以亚硫酸根的水解平衡常数为1×10-7,大于铵根的水解平衡常数,所以亚硫酸根的水解程度大,溶液显碱性,故答案为:碱性;SO32-的水解程度大于NH4+的水解程度;
③b点溶液呈中性,即c(H+)=c(OH-),同时溶液中存在电荷守恒2c(SO32-)+c(HSO3-)+ c(OH-)= c(NH4+)+ c(H+),则有2c(SO32-)+c(HSO3-)= c(NH4+),根据图像可知该点c(HSO3-)=c(SO32-),所以有3c(HSO3-)= c(NH4+),所以n(HSO3- ) : n(NH4+) =1:3;
(2)A.根据分析可知,在吸收二氧化硫之前,H2SO3是水解产生的,且为更为微弱的第二步水解产生,所以此时c(HSO3-)>c(H2SO3),故A错误;
B.NaHSO3溶液中存在硫酸氢根的电离和水解,根据图像可知硫酸氢钠水溶液显酸性即电离大于水解,所以c(SO32-)>c(H2SO3),溶液中存在c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),故B正确;
C.吸收至中性时存在电荷守恒2c(SO32-)+c(HSO3-)+ c(OH-)= c(Na+)+ c(H+),且此时c(H+)=c(OH-),所以有2c(SO32-)+c(HSO3-)=c(Na+)=0.2mol/L,故C正确;
D.当吸收溶液呈酸性时,溶液中有电荷守恒:2c(SO32-)+c(HSO3-)+ c(OH-)= c(Na+)+ c(H+),溶液显酸性则c(H+)<c(OH-),所以2c(SO32-)+c(HSO3-)>c(Na+),根据图像可知当溶液呈酸性时c(H2SO3)> c(SO32-)是,所以c(SO32-)+c(HSO3-)+c(H2SO3)> c(Na+),故D错误;
故答案为:BC;
(3)根据产物可知该过程中Cr2O72-被还原成Cr3+,二氧化硫做还原剂被氧化成硫酸根,根据电子守恒和元素守恒可得方程式为:3SO2+Cr2O72-+2H+ =2Cr3++3SO42-+H2O;故答案为:3SO2+Cr2O72-+2H+ =2Cr3++3SO42-+H2O;
(4)设铬元素完全转化为Cr(OH)3沉淀时溶液中的c(OH-)=amol/L,Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)=1×10-5×a3=1.0×10-32,解得a=1.0×10-9 amol/L,此时pH值为5,所以欲使废水中的铬元素完全转化为Cr(OH)3沉淀,应调节pH的范围为≥5,故答案为:≥5。


科目:高中化学 来源: 题型:
【题目】有机物甲的分子式为CxHyO2,其中氧的质量分数为20.25%,碳的质量分数为68.35%。在酸性条件下,甲水解生成乙和丙两种有机物;在相同温度和压强下,同质量的乙和丙的蒸气所占的体积相同,则甲的结构可能有
A.18种B.16种C.14种D.8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物![]() 的名称为2,4-二乙基-6-丙基辛烷
的名称为2,4-二乙基-6-丙基辛烷
B.若两种二肽互为同分异构体,则二者的水解产物一定不相同
C.醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物
D.1mol某有机物的结构简式为 通过消去反应脱去1molHCl时,能得到5种不同产物(不考虑立体异构)
通过消去反应脱去1molHCl时,能得到5种不同产物(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究小组将一批废弃的电子线路板简单处理后,得到含71%Cu、20%Al、5%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

已知:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
回答下列问题:
(1)滤渣1的主要成分为___。
(2)第②步加入H2O2目的是将Fe2+氧化成Fe3+,其离子方程式为___;使用H2O2作为氧化剂的优点是___。
(3)用第③步所得CuSO4·5H2O晶体加热制备无水CuSO4的瓷质主要仪器___。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:

上述三种方案中,可行方案是___,其中不可行方案的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图所示。
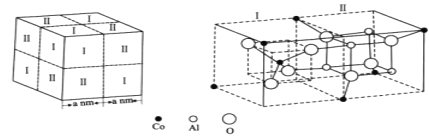
基态Co原子的价电子排布图为___。该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,NA为阿伏加德罗常数的值,钴蓝晶体的密度为___g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
①已知:放电时,负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应式为__。
②放电时,_____(填“正”或“负”)极附近溶液的碱性增强。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
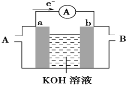
①使用时,空气从_____口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇(CH3OH),a极的电极反应式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com