
【题目】下列说法正确的是( )
A.按系统命名法,化合物![]() 的名称为2,4-二乙基-6-丙基辛烷
的名称为2,4-二乙基-6-丙基辛烷
B.若两种二肽互为同分异构体,则二者的水解产物一定不相同
C.醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物
D.1mol某有机物的结构简式为 通过消去反应脱去1molHCl时,能得到5种不同产物(不考虑立体异构)
通过消去反应脱去1molHCl时,能得到5种不同产物(不考虑立体异构)
【答案】C
【解析】
A.![]() 为烷烃的键线式,最长碳链含有10个C,主链为癸烷,编号从右边开始,在3号C含有一个甲基,在5、7号C各含有一个乙基,该化合物的名称应为:3-甲基-5、7-二乙基癸烷,A错误;
为烷烃的键线式,最长碳链含有10个C,主链为癸烷,编号从右边开始,在3号C含有一个甲基,在5、7号C各含有一个乙基,该化合物的名称应为:3-甲基-5、7-二乙基癸烷,A错误;
B.两种二肽互为同分异构,水解产物可能是相同的氨基酸,如:一分子甘氨酸和一分子丙氨酸形成的二肽中有两种构成方式,但二肽水解时的产物相同,B错误;
C. 醋酸和硬脂酸都为饱和一元羧酸,二者互为同系物,C2H6和C9H20符合烷烃的通式,均属于烷烃,也互为同系物,C正确;
D.由结构简式可知,3个-Cl原子均有2种不同的消去方式,则通过消去反应脱去1mol HCl时,能得到6种不同产物, D错误。
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质结构与性质的说法,不正确的是( )
A.I3AsF6晶体中存在I3+离子,I3+离子的几何构型为V形
B.硫离子电子共有18种运动状态,且其2p与3p轨道能量不相等
C.12g石墨中含有σ键的物质的量为3mol
D.第四周期元素中,Ga的第一电离能低于Ca
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在四支相同的试管中,分别装入等物质的量混合的两种气体。混合气体具体组成如下:
试管编号 | 1 | 2 | 3 | 4 |
混合气体组成 | Cl2、SO2 | NO2、O2 | NO、O2 | NH3、N2 |
将四支试管迅速同时倒立于水槽中,至液面稳定后,水面上升高度由大到小正确的是( )
A.1>2>3>4B.3>1>4>2
C.4>2>3>1D.1>3>2>4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基磷酸钙[Ca10(PO4)6(OH)2]具有优良的生物相容性和生物活性,它在口腔保健中具有重要作用,可以防止龋齿等,回答下列问题。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是___。
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的沸点是PH3___NH3(填“>”或“<”),原因是___。
(3)碳酸钙的分解温度远高于碳酸镁,其原因是__。
(4)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:其中最小的环为6元环,每个环平均含有__个P原子。
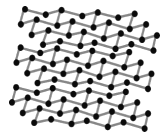
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,FeS、CuS的溶度积常数分别为6.3×10-18 mol2·L-2、1.3×10-36 mol2·L-2。下列说法中,错误的是( )
A.25℃时,FeS的溶解度大于CuS的溶解度
B.反应CuSO4+H2S=CuS↓+H2SO4不能发生
C.可用FeS作沉淀剂除去废水中的Cu2+
D.25℃时,饱和CuS溶液中,Cu2+的浓度为![]() ×10-18 mol·L-1
×10-18 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“烟气脱硫”是环境治理的重要工程,两种常见脱硫方法如下。回答相关问题:
方法I:用亚硫酸盐吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数与溶液pH的变化关系如图所示。
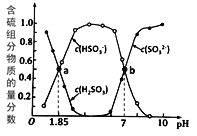
(1)若选用 (NH4)2SO3作为吸收液(已知NH3·H2O 的电离常数Kb=1.74×10-5):
①H2SO3的pKa1=________( pKa1 = -lgKa1);
②(NH4)2SO3溶液呈________(填“酸性”、“碱性”或“中性”),理由是________________;
③图中b点溶液中n(HSO3- ) : n(NH4+) =_________。
(2)若选用0.1mol/L 的Na2SO3作为吸收液,吸收过程中,下列有关粒子浓度关系一定正确的是(忽略溶液体积的变化)_________。
A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-)
B.NaHSO3溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
C.当吸收液呈中性时:2c(SO32-)+c(HSO3-)=0.2mol/L
D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
方法II:用含铬废水吸收烟气中的SO2。吸收原理如图所示:
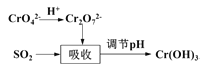
(3)“吸收”中反应的离子方程式为____________________
(4)欲使废水中的铬元素完全转化为Cr(OH)3沉淀,应调节pH的范围为____。(常温下Ksp[Cr(OH)3]=1.0×10-32)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)与时间(t)关系如右图。反应中镁和铝的
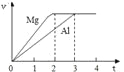
A. 物质的量之比为3:2 B. 质量之比为3:2
C. 摩尔质量之比为2:3 D. 反应速率之比为2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com