
【题目】羟基磷酸钙[Ca10(PO4)6(OH)2]具有优良的生物相容性和生物活性,它在口腔保健中具有重要作用,可以防止龋齿等,回答下列问题。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是___。
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的沸点是PH3___NH3(填“>”或“<”),原因是___。
(3)碳酸钙的分解温度远高于碳酸镁,其原因是__。
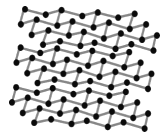
(4)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:其中最小的环为6元环,每个环平均含有__个P原子。
【答案】O>P>H>Ca < 氨分子间形成氢键,使熔沸点较高 镁离子半径小于钙离子半径,与氧离子形成的离子键更强,晶格能更大,因此碳酸镁的热分解温度低 2
【解析】
Ca10(PO4)6(OH)2中含有Ca、O、P、H四种元素,PH3与NH3的空间构型均为三角锥形;钙离子的半径大于镁离子;黑磷中最小的环为六元环,由图可知每个磷原子被3个环共用。
(1)同周期从左到右、同主族从下到上元素的电负性逐渐变大,Ca、O、P、H四种元素的电负性由大到小的顺序为O>P>H>Ca。
(2)氨分子间形成氢键,使熔沸点较高,故PH3的沸点小于NH3。
(3)由MgCO3和CaCO3都为离子晶体,MgCO3和CaCO3离子所带电荷相等,由于Mg2+半径小于Ca2+半径,所以MgO晶格能大于CaO晶格能,所以Mg2+比Ca2+更易与碳酸根离子中的氧离子结合,使碳酸根离子分解为CO2。
(4)黑磷与石墨烯相似,其中最小的环为六元环,由图可知每个磷原子被3个环共用,故每个环平均含有![]() 个P原子。
个P原子。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】(1)下表是不同温度下水的离子积数据:
温度/℃ | 25 | T1 | T2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
①已知25℃< T1< T2 ,在T1时,水中 c(H+)______c(OH-), 则a_____1×10-14(填“<”、“>”或“=”)。
②在T2下,将pH=1的H2SO4溶液V1 L与pH=11的NaOH溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =_________。
(2)常温下,将0.01 mol/L的CH3COOH溶液体积Va与0.01 mol/L的NaOH溶液体积Vb混合,已知:CH3COOH稀溶液的电离平衡常数为Ka=2×10-5。
a. Va=Vb时,等体积混合后测得溶液为碱性,原因是:_____(用离子方程式解释),该平衡的平衡常数Kh=_________。
b.混合后溶液的pH=7,则Va ____Vb(填“<”、“>”或“=”);该混合溶液中离子浓度由大到小的排列:______。
c.常温条件下,pH=11的CH3COONa溶液,由水电离出的c(OH-)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
D.标况下,11.2 L甲烷和乙烯的混合气体充分燃烧,所形成的O—H键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,下列说法中正确的是( )
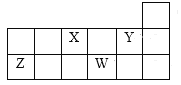
A.Z元素的最高价氧化物对应的水化物能与X的最简单气态氢化物的水溶液反应
B.X、Y、Z、W元素形成的简单离子半径由小到大的顺序为Z<X<Y<W
C.W的最简单气态氢化物的水溶液能与其最高价氧化物对应的水化物反应生成W元素对应的单质
D.X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物![]() 的名称为2,4-二乙基-6-丙基辛烷
的名称为2,4-二乙基-6-丙基辛烷
B.若两种二肽互为同分异构体,则二者的水解产物一定不相同
C.醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物
D.1mol某有机物的结构简式为 通过消去反应脱去1molHCl时,能得到5种不同产物(不考虑立体异构)
通过消去反应脱去1molHCl时,能得到5种不同产物(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )
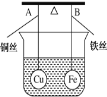
A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
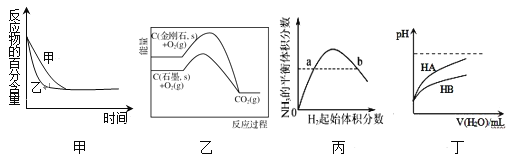
A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,![]() 与
与![]() 在多孔碳材料电极处生成
在多孔碳材料电极处生成![]() (
(![]() 或1)。下列说法正确的是
或1)。下列说法正确的是
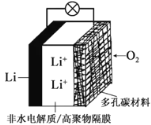
A.锂电极发生氧化反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com