
【题目】(1)下表是不同温度下水的离子积数据:
温度/℃ | 25 | T1 | T2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
①已知25℃< T1< T2 ,在T1时,水中 c(H+)______c(OH-), 则a_____1×10-14(填“<”、“>”或“=”)。
②在T2下,将pH=1的H2SO4溶液V1 L与pH=11的NaOH溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =_________。
(2)常温下,将0.01 mol/L的CH3COOH溶液体积Va与0.01 mol/L的NaOH溶液体积Vb混合,已知:CH3COOH稀溶液的电离平衡常数为Ka=2×10-5。
a. Va=Vb时,等体积混合后测得溶液为碱性,原因是:_____(用离子方程式解释),该平衡的平衡常数Kh=_________。
b.混合后溶液的pH=7,则Va ____Vb(填“<”、“>”或“=”);该混合溶液中离子浓度由大到小的排列:______。
c.常温条件下,pH=11的CH3COONa溶液,由水电离出的c(OH-)=___________。
【答案】= > 11:9 CH3COO- + H2O![]() CH3COOH + OH- 5×10-10 > c(Na+) = c(CH3COO- )> c(H+) = c(OH-) 1×10-3mol/L
CH3COOH + OH- 5×10-10 > c(Na+) = c(CH3COO- )> c(H+) = c(OH-) 1×10-3mol/L
【解析】
(1)①、在相同温度下,由水电离出的氢离子浓度等于氢氧根浓度,水是弱电解质,存在电离平衡,电离吸热,所以温度升高,水的电离程度增大,离子积增大,故答案为:=,> ;
②、混合后的氢离子浓度c(H+)=![]() =10-2mol/L,解得V1︰V2 =11:9,故答案为11:9;
=10-2mol/L,解得V1︰V2 =11:9,故答案为11:9;
(2)a、等体积等浓度混合后溶质为醋酸钠,醋酸根水解显碱性,离子方程式为CH3COO- + H2O![]() CH3COOH + OH-,水解平衡常数表达式Kh=
CH3COOH + OH-,水解平衡常数表达式Kh=![]() =
=![]() =
=![]() =1×10-14÷(2×10-5)=5×10-10,故答案为:CH3COO- + H2O
=1×10-14÷(2×10-5)=5×10-10,故答案为:CH3COO- + H2O![]() CH3COOH + OH-,5×10-10;
CH3COOH + OH-,5×10-10;
b、等体积等浓度混合后显碱性,现在显中性,则酸过量,故Va >Vb,故答案为:>;
该混合液中的电荷守恒:c(Na+)+ c(H+) = c(CH3COO- )+c(OH-),由于c(OH-)= c(H+),所以c(Na+) =c(CH3COO- ),故答案为:c(Na+) =c(CH3COO- )> c(H+)= c(OH-);
c、常温条件下,pH=11的CH3COONa溶液,溶液中的![]() ,则
,则![]() ,
,![]() 全由水电离出,故由水电离出的c(OH-)= 1×10-3mol/L,故答案为: 1×10-3mol/L 。
全由水电离出,故由水电离出的c(OH-)= 1×10-3mol/L,故答案为: 1×10-3mol/L 。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用类推的方法可能会得出错误结论,因此推出的结论需要经过实践的检验才能确定其正确与否。下列有关推论正确的是( )
①BrCl的化学性质和Cl2相似,Cl2与水反应是氧化还原反应,BrCl+H2O=HCl+HBrO也是氧化还原反应
②Fe3O4可以写成FeOFe2O3的形式,Pb3O4也可写成PbOPb2O3的形式
③37℃时,Fe3+能催化H2O2的分解;80℃时,MnO2、过氧化氢酶也能催化H2O2的分解
④电解CuCl2溶液阴极析出Cu,电解AlCl3溶液阴极上析出的是Al
A.0句B.1句C.2句D.3句
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )

A.达到平衡后,若使用催化剂,C的体积分数将增大
B.该反应的ΔH<0
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
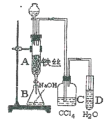
(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置不能完成对应实验的是( )
A.图甲可以用来制备Fe(OH)3胶体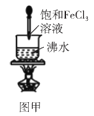
B.图乙可以用来证明酸性强弱顺序:H2SO4>H2CO3>H2SiO3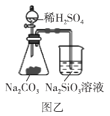
C.图丙可以通过点燃肥皂泡来检验是否有氢气气体生成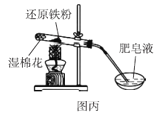
D.图丁可以用陶瓷坩埚加热融化NaOH固体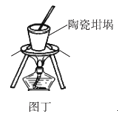
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由Na2SiO3、BaSO4、BaCO3、Na2SO3、NaOH中的一种或几种组成,为了探究它的成分,进行了如下实验:

下列判断错误的是( )
A.生成白色沉淀D的离子方程式为SiO32-+2H+=H2SiO3↓
B.BaSO4一定不存在,NaOH可能存在
C.Na2SiO3、BaSO4、BaCO3、Na2SO3一定存在,NaOH可能存在
D.气体B和气体E均可使澄清的石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是某课题组设计的合成聚酯类高分子材料的路线:
已知:同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮
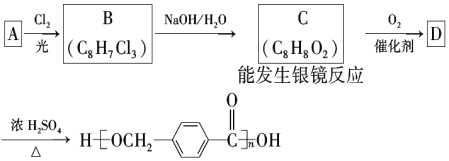
请根据以上信息回答下列问题:
(1)烃A的结构简式为________、
(2)A的化学名称为________。
(3)由B生成C的化学方程式为________。
(4)C的同分异构体中,既能与FeCl3溶液发生显色反应,又能发生银镜反应的有机物共有________种,其中在核磁共振氢谱中出现五组峰的有机物的结构简式为__________________________。
(5)D的结构简式为________,D的某同分异构体中含有苯环的碳酸二酯在酸性条件下发生水解反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基磷酸钙[Ca10(PO4)6(OH)2]具有优良的生物相容性和生物活性,它在口腔保健中具有重要作用,可以防止龋齿等,回答下列问题。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是___。
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的沸点是PH3___NH3(填“>”或“<”),原因是___。
(3)碳酸钙的分解温度远高于碳酸镁,其原因是__。
(4)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:其中最小的环为6元环,每个环平均含有__个P原子。
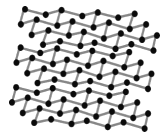
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com