
����Ŀ�������Ƶķ������ܻ�ó�������ۣ�����Ƴ��Ľ�����Ҫ����ʵ���ļ������ȷ������ȷ��������й�������ȷ���ǣ� ��
��BrCl�Ļ�ѧ���ʺ�Cl2���ƣ�Cl2��ˮ��Ӧ��������ԭ��Ӧ��BrCl+H2O=HCl+HBrOҲ��������ԭ��Ӧ
��Fe3O4����д��FeOFe2O3����ʽ��Pb3O4Ҳ��д��PbOPb2O3����ʽ
��37��ʱ��Fe3+�ܴ�H2O2�ķֽ⣻80��ʱ��MnO2����������øҲ�ܴ�H2O2�ķֽ�
�ܵ��CuCl2��Һ��������Cu�����AlCl3��Һ��������������Al
A.0��B.1��C.2��D.3��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�������SOCl2��������ҽҩ��ũҩ��Ⱦ�Ϲ�ҵ��Ҳ�����л��ϳɹ�ҵ�����Ȼ�������֪��SOCl2������������±���ʾ��
��ɫ��״̬ | �۵� | �е� | ��ʴ�� | ˮ�� |
��ɫ����Һ�� | -105�� | 78�� | ǿ | ����ˮ�� |
��������ͼװ���Ʊ�SOCl2��
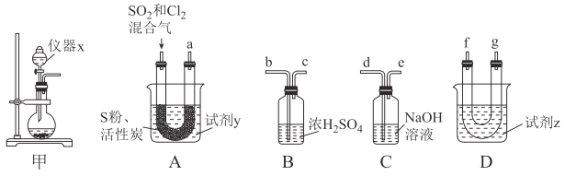
��ش��������⣺
���Ʊ�SO2��Cl2��
��1����ʵ��ѡ��װ�ü��Ʊ�SO2��Cl2��װ�ü�������x������Ϊ___������KMnO4��Ũ���ᷴӦ�Ʊ�Cl2����Ӧ�����ӷ���ʽΪ___��
���Ʊ�SOCl2��
�Ի���̿��Ϊ������SO2��C12���Ժ�S����180~200��ʱ��Ӧ�ϳ�SOCl2��ѡ��װ��A��B��C��D�����Ʊ����г֡�����װ����ȥ����
��2�������������ҵķ���װ��A��B��C��D������˳��Ϊ___���������ӿڵ���ĸ��ţ���
��3���Լ�yΪ___����ѡ����ĸ����ͬ�����Լ�zΪ___��
A����ˮ B���Ҵ� C��ʯ���� D����ˮ
��4��װ��A��U�ι��ڷ�����Ӧ�Ļ�ѧ����ʽΪ___��
��5��װ��C������Ϊ___����װ��A��ͨ���SO2��Cl2�����ʵ���֮��Ϊ1��3����װ��C�����ɵ���Ϊ___���ѧʽ���������ʵ����֤װ��C�����ɵ����к���SO42-��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������۷���Ϣ�صijɷ�֮һ�������㽶����ζ��ʵ�����Ʊ������������ķ�Ӧ��װ��ʾ��ͼ���й��������£�
![]()
��Ŀ | ��Է������� | �ܶ�/(g��cm3) | �е�/�� | ˮ���ܽ��� |
���촼 | 88 | 0.8123 | 131 | �� |
���� | 60 | 1.0492 | 118 | �� |
���������� | 130 | 0.8670 | 142 | ���� |
ʵ�鲽�裺
��A�м���4.4g���촼��6.0g���ᡢ����Ũ�����2��3Ƭ���Ƭ����ʼ��������A������50min����ӦҺ�������º����Һ©���У��ֱ�������ˮ������̼��������Һ��ˮϴ�ӣ��ֳ��IJ������������ˮMgSO4���壬����Ƭ�̣����˳�ȥMgSO4���壬�����������ռ�140��143����֣�������������3.9g��
�ش��������⣺
��1������B��������___��
��2����ϴ�Ӳ����У���һ��ˮϴ�͵ڶ���ˮϴ����ҪĿ�ķֱ���___��
��3����ϴ�ӡ���Һ�����У�Ӧ�����Ȼ���ã����ֲ��__(����)��
a.ֱ�ӽ������������ӷ�Һ©�����Ͽڵ���
b.ֱ�ӽ������������ӷ�Һ©�����¿ڷų�
c.�Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ��������������¿ڷų�
d.�Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ��������������Ͽڵ���
��4��ʵ���м���������ˮMgSO4��Ŀ����___��
��5����ʵ��IJ�����___(����)��
a.30% b.40% c.60% d.90%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(CN)2�Ľṹ��ʽΪN��C��C��N���仯ѧ������±��(X2)�����ƣ���ѧ�ϳ�֮Ϊ��±�أ��������Խ���Br2��I2֮�䡣�����йط�Ӧ�Ļ�ѧ����ʽ����ȷ����(����)
A. (CN)2��H2=2HCN
B. MnO2��4HCN=Mn(CN)2��(CN)2����2H2O
C. ��KCN��Һ�м����ˮ��I2��2KCN=2KI��(CN)2
D. ��NaBr��KCN���Һ��ͨ������Cl2��Cl2��2KCN=2KCl��(CN)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Al2O3) �͵����裨Si3N4���������ĸ��½ṹ�մɣ��ڹ�ҵ�����ͿƼ���������Ҫ��;��
��1��Al��NaOH��Һ��Ӧ�����ӷ���ʽΪ_____________________________________��
��2������ʵ���ܱȽ�þ�����Ľ�����ǿ������____________������ţ���
a���ⶨþ�����ĵ�����ǿ��
b���ⶨ�����ʵ���Ũ�ȵ�Al2(SO4)3��MgSO4��Һ��pH
c����0.1 mol/L AlCl3��0.1 mol/L MgCl2�мӹ���NaOH��Һ
��3�����ȷ��dz��õĽ���ұ������֮һ��
��֪��4Al (s)+3O2(g) =2Al2O3(s) ��H1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ��H2 = -521 kJ/mol
Al��MnO2��Ӧұ������Mn���Ȼ�ѧ����ʽ��_____________________________��
��4����ҵ���û�ѧ����������Ʊ������裬�䷴Ӧ���£�
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) ��H��0
Si3N4(s) + 12HCl(g) ��H��0
ij�¶Ⱥ�ѹǿ�����£��ֱ�0.3mol SiCl4(g)��0.2mol N2(g)��0.6mol H2(g)����2L�ܱ������ڣ�����������Ӧ��5min�ﵽƽ��״̬������Si3N4(s)��������5.60g��
��H2��ƽ����Ӧ������_________ mol��(L��min)��
������n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6��Ͷ����ȣ���������������������ϣ�SiCl4(g)��ת����Ӧ______�����������С�����䡱����
��5��298Kʱ��Ksp[Ce(OH)4]��1��10��29��Ce(OH)4���ܶȻ�����ʽΪKsp��_______________��
Ϊ��ʹ��Һ��Ce4��������ȫ������������Һ�е�c(Ce4+)С��1��10��5mol��L��1�������pHΪ______���ϡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���������������ԭ�����͵���
A. ����ɫ��NO2����ѹ����ɫ�ȱ�����dz
B. ��ѹ�ȳ�ѹ�����ںϳ�SO3�ķ�Ӧ
C. ������������ڰ��ĺϳ�
D. ��ҵ��ȡ������Na(l)+KCl(l)![]() NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��д��ȷ���ǣ� ��
A. H2S �ĵ��뷽��ʽ��H2S��H2O![]() H3O����HS��
H3O����HS��
B. NaHCO3��ˮ��Һ�еĵ��뷽��ʽ��NaHCO3= Na����H++CO32-
C. CO32����ˮ�ⷽ��ʽ��CO32-��2H2O![]() H2CO3��2OH��
H2CO3��2OH��
D. HS-��ˮ�ⷽ��ʽ��HS-��H2O![]() S2-��H3O��
S2-��H3O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ��������̬��������δ���ķ�չ���⣬��CO2����Ч���ÿ��Ի�������ЧӦ�������Դ��ȱ���⡣
(1)CO2��CH4�����������Ƶúϳ�����CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H
2CO(g)+2H2(g) ��H
��֪����Ӧ1 CH4(g)�TC(s)+2H2(g) ��H1= +75kJ/mol
��Ӧ2 2CO(g)�TC(s)+CO2(g) ��H2=��172kJ/mol
��ô�������Ӧ����H=___kJmol-1��
(2)�п�ѧ�����������FeO����CO2��6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s)���Ը÷�Ӧ��������ȷ����__��
2Fe3O4(s)+C(s)���Ը÷�Ӧ��������ȷ����__��
A.����FeO��Ͷ����������ƽ�������ƶ�
B.ѹ�����������������CO2��ת���ʣ�c(CO2)��С
C.���º����£�������ܶȲ������Ϊƽ��ı�־
D.���º�ѹ�£�����Ħ�������������Ϊƽ��ı�־
E.���÷�Ӧ����H��0����ﵽ��ѧƽ��������¶ȣ�CO2�����ʵ���������
(3)Ϊ�о�CO2��CO֮���ת������һ������CO2������̼������ɱ���ܱ������з�Ӧ��C(s)+CO2(g)![]() 2CO(g) H�����ѹǿ���¶ȶ�CO���������[��(CO)%]��Ӱ����ͼ��ʾ���ش��������⣺
2CO(g) H�����ѹǿ���¶ȶ�CO���������[��(CO)%]��Ӱ����ͼ��ʾ���ش��������⣺
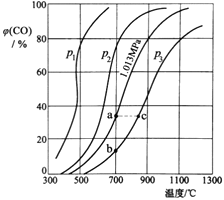
��ͼ��p1��p2��p3�Ĵ�С��ϵ��______��ͼ��a��b��c�����Ӧ��ƽ�ⳣ��Ka��Kb��Kc�Ĵ�С��ϵ��______��
��900�桢1.013MPaʱ��1molCO2������̼��Ӧ��ƽ������������ΪVL��CO2��ת����Ϊ___������һλС�������÷�Ӧ��ƽ�ⳣ��K��___��
�۽�����ƽ����ϵ�¶Ƚ���640�棬ѹǿ����0.1013MPa�����´ﵽƽ���CO2���������Ϊ50%�������ı�ʱ������Ӧ����______�淴Ӧ����(����>������<������=��)��
(4)��NaOH��Һ��ͨ��һ������CO2���壬������Һ��c(HCO3-)��c(CO32-)=4��1����ʱ��ҺpH=______������֪�������£�H2CO3��k1=4��10-7��k2=5��10-11��lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�
�¶�/�� | 25 | T1 | T2 |
Kw/ mol2��L-2 | 1��10-14 | a | 1��10-12 |
�Իش����¼������⣺
����֪25��< T1< T2 ����T1ʱ��ˮ�� c(H+)______c(OH-)�� ��a_____1��10-14������<������>������=������
����T2�£���pH=1��H2SO4��ҺV1 L��pH=11��NaOH��ҺV2 L��ϣ����Ϻ���Һ���Ϊԭ����Һ���֮�ͣ�������Һ��pH=2����V1�UV2 =_________��
��2�������£���0.01 mol/L��CH3COOH��Һ���Va��0.01 mol/L��NaOH��Һ���Vb��ϣ���֪��CH3COOHϡ��Һ�ĵ���ƽ�ⳣ��ΪKa=2��10-5��
a. Va=Vbʱ���������Ϻ�����ҺΪ���ԣ�ԭ���ǣ�_____�������ӷ���ʽ���ͣ�����ƽ���ƽ�ⳣ��Kh=_________��
b.��Ϻ���Һ��pH=7����Va ____Vb������<������>������=�������û����Һ������Ũ���ɴ�С�����У�______��
c.������������pH=11��CH3COONa��Һ����ˮ�������c(OH-)=___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com