
【题目】有一包白色粉末,由Na2SiO3、BaSO4、BaCO3、Na2SO3、NaOH中的一种或几种组成,为了探究它的成分,进行了如下实验:

下列判断错误的是( )
A.生成白色沉淀D的离子方程式为SiO32-+2H+=H2SiO3↓
B.BaSO4一定不存在,NaOH可能存在
C.Na2SiO3、BaSO4、BaCO3、Na2SO3一定存在,NaOH可能存在
D.气体B和气体E均可使澄清的石灰水变浑浊
【答案】C
【解析】
由探究实验流程可知,白色滤渣A与盐酸反应生成气体B,则A为CaCO3,B为CO2,无色溶液C与盐酸反应生成白色沉淀,则C中含Na2SiO3、Na2SO3,白色沉淀D为硅酸,气体E为SO2,由上分析可知,一定存在Na2SiO3、Na2SO3、CaCO3,不存在BaSO4,无法判断NaOH,以此来解答。
A. 生成白色沉淀D为硅酸,离子方程式为SiO32-+2H+=H2SiO3↓,A项正确;
B. 由分析可知,BaSO4一定不存在,NaOH可能存在,B项正确;
C. 由分析可知,BaSO4一定不存在,C项错误;
D. B为CO2,E为SO2,均可使澄清的石灰水变浑浊,D项正确;
答案选C。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子![]() 或化学
或化学![]() 方程式正确的是
方程式正确的是
A.苯酚钠溶液中通入少量二氧化碳:![]() +H2O+CO2→
+H2O+CO2→![]() +CO32-
+CO32-
B.CH3CO18OC2H5在稀硫酸催化下水解:CH3CO18OC2H5+H2O![]() CH3COOH+C2H518OH
CH3COOH+C2H518OH
C.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
D.乙烯通入到溴水中:H2C=CH2+Br2→C2H4Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下表是不同温度下水的离子积数据:
温度/℃ | 25 | T1 | T2 |
Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
①已知25℃< T1< T2 ,在T1时,水中 c(H+)______c(OH-), 则a_____1×10-14(填“<”、“>”或“=”)。
②在T2下,将pH=1的H2SO4溶液V1 L与pH=11的NaOH溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 =_________。
(2)常温下,将0.01 mol/L的CH3COOH溶液体积Va与0.01 mol/L的NaOH溶液体积Vb混合,已知:CH3COOH稀溶液的电离平衡常数为Ka=2×10-5。
a. Va=Vb时,等体积混合后测得溶液为碱性,原因是:_____(用离子方程式解释),该平衡的平衡常数Kh=_________。
b.混合后溶液的pH=7,则Va ____Vb(填“<”、“>”或“=”);该混合溶液中离子浓度由大到小的排列:______。
c.常温条件下,pH=11的CH3COONa溶液,由水电离出的c(OH-)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中通过酸碱中和滴定实验测定盐酸的浓度。取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用标准的NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.10 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.90 | 20.00 |
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_____________________。
(2)该实验滴定达到终点的标志是__________________________。
(3)根据上述数据,可计算出该盐酸的浓度约为_________。(保留两位有效数字)
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。
A滴定终点读数时俯视读数
B滴定过程中,不小心滴到桌子上几滴
C碱式滴定管尖嘴部分有气泡,滴定后消失
D锥形瓶水洗后未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL无色溶液可能含有Na+、NH4+、Mg2+、Al3+、Fe3+、CO32-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)
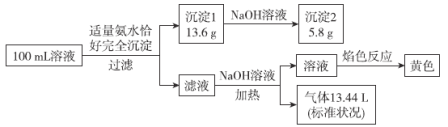
下列说法错误的是( )
A.原溶液一定存在Na+、NH4+、Mg2+、Al3+和Cl-,一定不存在Fe3+、CO32-
B.原溶液中c(NH4+)=1mol·L-1
C.沉淀2的成分为Mg(OH)2
D.原溶液中c(Cl-)≥6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲的分子式为CxHyO2,其中氧的质量分数为20.25%,碳的质量分数为68.35%。在酸性条件下,甲水解生成乙和丙两种有机物;在相同温度和压强下,同质量的乙和丙的蒸气所占的体积相同,则甲的结构可能有
A.18种B.16种C.14种D.8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
D.标况下,11.2 L甲烷和乙烯的混合气体充分燃烧,所形成的O—H键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com