
| A. | 在蒸发结晶操作中,用酒精灯加热直至溶液完全蒸干才停止加热 | |
| B. | 配制一定物质的量浓度溶液时,容量瓶必须事先干燥 | |
| C. | 用量筒取用5.0ml液体时,俯视刻度线,会使所取液体体积大于5.0ml | |
| D. | 铁氰化钾可用于Fe2+的检验 |
分析 A.蒸发时,不能蒸干,否则会导致固体飞溅;
B.配制溶液时,容量瓶不需要干燥;
C.俯视量筒刻度线,量取的溶液体积偏小;
D.含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀.
解答 解:A.在蒸发结晶操作中,用酒精灯加热直至蒸发皿中含有少量液体是就停止加热,利用余热将固体蒸干,而不能直接蒸干,故A错误;
B.配制一定物质的量浓度的溶液时,容量瓶不需要干燥,对溶质的物质的量、最终溶液体积都无影响,故B错误;
C.用容量瓶量取5.0mL溶液时,俯视容量瓶刻度线,导致量取的溶液体积偏小,即小于5.0mL,故C错误;
D.Fe2+与铁氰化钾K3[Fe(CN)6]反应生成具有特征蓝色的铁氰化亚铁沉淀:2[Fe(CN)6]3-+3Fe2+═Fe3[[Fe(CN)6]2↓,故可用铁氰化钾检验Fe2+,故D正确;
故选D.
点评 本题考查了实验方案的设计与评价,题目难度中等,涉及化学实验基本操作方法偏大、常见离子的检验方法、配制一定物质的量浓度的溶液方法等知识,注意掌握常见化学实验基本操作方法,明确常见离子的检验方法,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙干燥氨气 | |
| C. | 用装置丙除去甲烷中混有的乙烯 | |
| D. | 利用装置丁制取硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
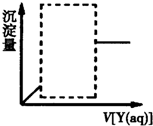 X、Y是浓度均为0.1mol•L-1的下列溶液中的某一种:①MgSO4溶液②Al2(SO4)3溶液③Ba(OH)2溶液④NaOH溶液.现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积关系如图所示(图中虚线框内曲线已省略),则符合该图象的X、Y的组合共有( )
X、Y是浓度均为0.1mol•L-1的下列溶液中的某一种:①MgSO4溶液②Al2(SO4)3溶液③Ba(OH)2溶液④NaOH溶液.现向溶液X中逐滴加入溶液Y,得到的沉淀量与所加Y溶液的体积关系如图所示(图中虚线框内曲线已省略),则符合该图象的X、Y的组合共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL 量筒量取 5.2 mL 盐酸 | |
| B. | 用10mL 量筒量取 5.2 mL 盐酸 | |
| C. | 用托盘天平称取 25.02 g NaCl | |
| D. | 用广泛pH试纸测得某溶液的pH值为4.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵增加且放热的反应一定能自发进行 | |
| B. | 若可逆反应正、逆反应速率改变,则化学平衡一定发生移动 | |
| C. | 放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应 | |
| D. | 若某化学平衡发生移动,则平衡混合体系的压强一定发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气在空气中燃烧的反应 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | 铁粉与稀硫酸的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com