
分析 (1)处于中间价态的微粒既有氧化性,也有还原性;
(2)NaNO2把人体内的Fe2+转化为Fe3+,Fe元素的化合价升高,则N元素的化合价降低;
(3)维生素C可将Fe3+转化为Fe2+,则维生素C中某元素的化合价升高;
(4)NaHSO4在水中的电离钠离子、氢离子和硫酸根离子.
解答 解:(1)+2价为Fe元素的中间价态,亚铁离子既有氧化性,也有还原性,
故答案为:B;
(2)NaNO2把人体内的Fe2+转化为Fe3+,Fe元素的化合价升高,则N元素的化合价降低,NaNO2具有氧化性,氧气具有氧化性,可实现该转化,
故答案为:氧化;A;
(3)维生素C可将Fe3+转化为Fe2+,则维生素C中某元素的化合价升高,所以具有还原性,
故答案为:还原;
(4)NaHSO4在水中的电离钠离子、氢离子和硫酸根离子,其电离方程式为NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将水库的钢闸门与电源负极相连或将锌块焊接于闸门上以防止其生锈 | |
| B. | 用于文物年代鉴定的放射性14C和作为原子量标准的12C,化学性质不同 | |
| C. | 苯酚、甲醛分别可用于环境消毒和鱼肉等食品的防腐保鲜 | |
| D. | NO2和SO2都是酸性氧化物,都是大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发结晶操作中,用酒精灯加热直至溶液完全蒸干才停止加热 | |
| B. | 配制一定物质的量浓度溶液时,容量瓶必须事先干燥 | |
| C. | 用量筒取用5.0ml液体时,俯视刻度线,会使所取液体体积大于5.0ml | |
| D. | 铁氰化钾可用于Fe2+的检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L浓度为0.5 mol/L 硫酸溶液中含有NA个氢离子 | |
| B. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| C. | 由14g CO中含有的原子数为NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,转移电子数4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好完全沉淀H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 用NaOH吸收少量二氧化硫 OH-+SO2═HSO3- | |
| C. | 氯化铝溶液中加过量氨水Al3++3NH3.H2O═Al(OH)3↓+3 NH4+ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳 ClO-+H2O+CO2═HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
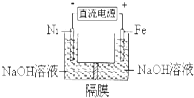
| A. | 铁是阳极,电极反应为Fe-6e-+4H2O═FeO42-+8H+ | |
| B. | 若隔膜为阴离子交换膜,则OH-自左向右移动 | |
| C. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| D. | 每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com