
| A. | m1=m2 | B. | m1>m2 | C. | m1<m2 | D. | 无法确定 |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:填空题
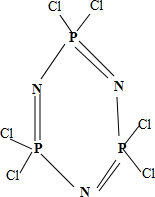 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的生成速率与NH3的分解速率相等 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
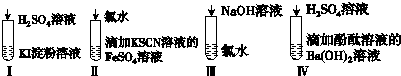
| 选项 | 现象 | 离子方程式 |
| A | I在空气中放置一段时间后,溶液呈蓝色 | 4I-+O2+2H2O═2I2+4OH- |
| B | II溶液由浅绿色变为红色 | Fe2++Cl2═Fe3++2Cl- Fe3++3SCN-═Fe(SCN)3 |
| C | III溶液 颜色无变化 | Cl2+2OH-═Cl-+ClO-+H2O |
| D | IV有白色沉淀生成,溶液由红色变无色 | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3- | B. | MnO4- | C. | Cl2 | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编 号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1mol•L-1KI溶液 | 0.1mol•L-1H2O | X 0.1mol•L-1溶液 | 0.1mol•L-1双氧水 | 0.1mol•L-1稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
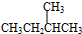 与
与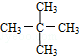 G.
G.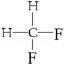 与
与 
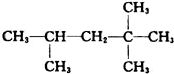 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为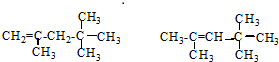 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com